
撰文:步步先生/南山小仙
来源:干细胞者说
● ● ●自身免疫性疾病影响了世界上5%~8%的人口,给患者造成了巨大的痛苦,其中女性受到的影响尤为严重。近年来,干细胞疗法被用作一种新的治疗方法,逐步迈向临床试验,如自身免疫性疾病。自身免疫性疾病(Autoimmune Disease)简称AID,是一种免疫应答紊乱,机体免疫系统对自身抗原攻击,造成组织器官损伤和功能障碍的疾病,具有较高的致残率和致死率。目前,至少有100种自身免疫性疾病(可查阅:关于自身免疫性疾病,你知道多少种),我们持续关注的主要有:类风湿性关节炎(RA)
多发性硬化(MS)
系统性红斑狼疮(SLE)
炎症性肠病(IBD)
干燥综合征((SS)
自身免疫性肝病(AIH)
-01-
从炎症反应说起
炎症是抵御有害物质入侵生命的一种防御机制。通常,炎症可由创伤、感染、恶劣环境因素和不良生活方式(如吸烟酗酒,长期熬夜)等引发。免疫细胞保护机体,抵抗感染和其他疾病进展过程,并帮助机体损伤组织愈合。当察觉到敌人时,免疫细胞会派出促炎分子形成“即时炎症”,一旦愈合过程发生就消失了,这对修复机体和对抗感染至关重要(此时炎症反应对机体是有利的)。
但当“即时炎症”持续成“慢性炎症”,并影响整个机体,炎症才成为身体真正的"问题"。慢性炎症是自身免疫性疾病的标志。在自身免疫性疾病中,免疫反应被劫持。正常有序、有限的免疫过程失去控制,变成破坏性的炎症免疫反应。于是,这就开始恶性循环,促进全身性慢性炎症(造成机体免疫系统自我无序的攻击)。
炎症反应,相当于一个在“帮助”你开车的同时,长期反应过度的后座司机。炎症反应会导致血液流动减少。没有良好的血液循环,细胞死亡和疤痕开始形成,最终导致组织和器官退化。自身免疫性疾病会破坏关节、肠道、结缔组织、内脏、神经和脑细胞。
-02-
炎症调控大师:间充质干细胞在疾病或损伤部位,间充质干细胞可调动附近的细胞进行有效地工作。通过调节各种免疫细胞和刺激局部内源性组织特异性干细胞增殖分化,恢复机体工作,尽其所能减少炎症,平息过度活跃的免疫反应。一旦“后座驱动”功能减弱,间充质干细胞就会继续工作,通过增加血液循环和血管新生,防止细胞进一步凋亡,并减少疤痕大小。最后,间充质干细胞成为组织再生的基石。机体的自然愈合,有时候只是需要增援而已。机体修复过程,涉及全身炎症和免疫系统的恢复平衡机制。除了调节自身免疫病中的炎症免疫反应,愈合过程可以扩展到包括自身免疫病影响的器官的修复行动。 由于间充质干细胞的多种功能,可以促进血管新生,保护和支持神经元。可以再生隔离神经的髓鞘,支持肌肉和骨骼的结缔组织,以及关节软骨。那么,间充质干细胞(MSCs)会是合格的炎症调控大师吗?
大约超过7000篇关于MSCs的论文在2018年发表,788项已经完成或正在进行的MSCs临床研究。自从20世纪70年代Friedenstein等人发现MSCs以来,MSCs就一直是学术界和临床转化研究的焦点。
MSCs具有自我更新和多向分化的潜能。由于易分离和易扩增的特点,MSCs成为再生医学中最常用的细胞。此外,因为具有免疫调节特性,MSCs 疗法为自身免疫病、炎症和血液病等疾病提供了一个很有前景的治疗手段。

-03-
间充质干细胞与自身免疫性疾病
在临床前和临床试验中,科学家一直努力探索间充质干细胞的治疗潜力,以期证明对自身免疫病治疗的安全性和有效性。既往研究表明,间充质干细胞可以抑制T淋巴细胞的增殖和功能,降低TNF-α的浓度,增加Treg细胞数量,调节炎症介质的表达。因此,间充质干细胞可用于调节自身免疫性疾病失衡的免疫状态。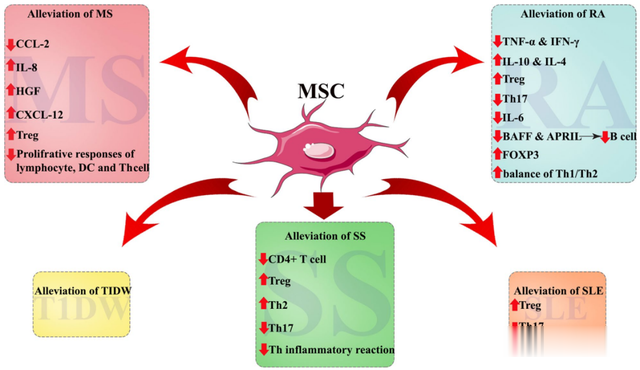 图3. 间充质干细胞在自身免疫性疾病中的临床应用▉ 类风湿关节炎(RA)
图3. 间充质干细胞在自身免疫性疾病中的临床应用▉ 类风湿关节炎(RA)类风湿关节炎(Rheumatoid arthritis,RA)是全球最常见的全身性自身免疫性疾病。其特征是关节炎症、滑膜增生以及进行性关节损害、软骨和骨破坏,最终导致残疾。研究表明RA的发病与机体免疫失衡有关。Th17细胞和Treg细胞的不平衡导致自身免疫反应激活,从而免疫细胞攻击关节。
利用MSCs的免疫调节功能来重构免疫系统,是当下研究方向。MSCs可通过不同的机制改善RA症状(例如抑制Th17细胞,减少炎性因子并增加抗炎因子,上调Treg细胞水平等)。
据文献报道,研究者对9名难治性RA患者静脉注射1×10*6个自体骨髓间充质干细胞(BM-MSCs)。结果显示:BM-MSCs注射后,Th17细胞百分率显著下降,Treg细胞显著增加。疾病活动性评分(DAS28-ESR)及评价患者疼痛水平的视觉模拟评分(VAS)均明显降低。这些数据表明,间充质干细胞对改善难治性RA有一定效果。
▉ 多发性硬化(MS)
多发性硬化症(Multiple Sclerosis,MS)是最常见的一种中枢神经脱髓鞘疾病,属于慢性自身免疫性疾病。目前,患病机制尚不清楚,一般认为反应性T细胞在自身反应性抗原的刺激下,造成中枢神经系统脱髓鞘和进行性神经变性。目前,药物治疗(激素或免疫调节剂)有助于减缓疾病进展,但副作用严重,且不能逆转。
据文献报道,在一项48名受试者的临床试验中,随机分三组:鞘内给药、静脉给药和空白对照,分别接受单次BM-MSCs输注和假注射对照。结果显示,接受单次BM-MSCs注射治疗的患者病情得到显著改善,在功能系统评分和影像学评估上也有明显缓解。同时,鞘内注射比静脉注射改善程度更大。
▉ 系统性红斑狼疮(SLE)
系统性红斑狼疮(SLE)是一种好发于育龄期女性的自身免疫病,以累及多脏器、产生自身抗体和免疫复合物为特征。其发病机制复杂,包括遗传及环境等诸多因素共同致病。目前我国SLE发病率为(20-70)/10万,患病人数超过100万,且呈逐年增长趋势。
目前全球已经有1500多例SLE患者接受了MSCs治疗,其中大部分患者接受的是异体MSCs移植。疗效方面,异体MSCs治疗1年后60.5%的患者获得完全缓解,尿蛋白(24h)、不列颠群岛狼疮评估组评分(BILAG)明显下降;治疗4年后50%的患者仍获得临床缓解,4年生存率为94%,总复发率仅为23%。此外,对于重症难治性SLE,有效率达60%,使重症难治性SLE患者5年病死率从原来的35%-45%下降至16% 。
安全性方面,患者对MSCs移植治疗的耐受性良好,少数患者会出现发热、出汗、心悸、面部潮红等一过性输液反应,未见严重不良反应,无移植相关死亡。在一项回顾性研究中,纳入了404名接受异体MSCs移植的自身免疫病患者,其中SLE患者为178名,占44.1% 。所有患者的平均随访时间为 43.4 ± 25.9 个月,结果表明,异体MSCs输注对于SLE等自身免疫性疾病患者来说是一种安全的治疗方法。这些患者的不良事件发生率,无论是感染还是恶性肿瘤,都处于可控范围。

▉ 炎症性肠病(IBD)
炎症性肠病(Inflammation Bowel Disease,IBD)是一种慢性胃肠道自身免疫性疾病,主要是由遗传易感宿主对病原体的不适当和持续的免疫反应引起的。间充质干细胞免疫原性低,可趋向到活动性炎症部位进行免疫调节和促进组织再生。因此,间充质干细胞有望成为重塑IBD肠道稳态的新手段。
在一项随机对照临床试验中,纳入82名CD患者,其中41名患者接受了脐带间充质干细胞(UC-MSC)静脉注射,每周一次,共4次,其余41名为对照组接受常规治疗。随访12个月后发现,接受脐带间充质干细胞治疗的患者可以显著改善CD症状,并不会发生严重不良反应。
克罗恩病是炎症性肠病的一种。目前,已有间充质干细胞药物Alofisel®在欧盟(2018年获批上市)、日本(2021年获批上市)等获批上市用于治疗非活动期或轻度活动期的克罗恩病相关的复杂肛周瘘管。Alofisel®是一款人同种异体脂肪间充质干细胞产品。武田制药公布真实世界分析结果,证实了Alofisel治疗的长期效果以及安全性:大部分受试者外部开口均可闭合,不会出现闭口裂开的情况;受试者在治疗期间没有异位组织形成,也没有死亡的报告
▉ 干燥综合征(SS)
我国约有1000万左右的干燥综合征患者,女性患者约是男性患者的9倍。该病常见的发病年龄在45岁到55岁。在我国,干燥综合征是仅次于类风湿性关节炎的第二大结缔组织病。
有报道对24名干燥综合征患者(11例唾液腺受损,13例存在多器官受累)静脉注射UC-MSCs,该研究结果显示,UC-MSCs移植显著地缓解了患者的干燥综合征症状,极大程度地降低了干燥综合征疾病活动指数(Sjogren’s syndromedisease activity index,SSDAI)和VAS评分(视觉模拟评分法,visual analogue scale),并且未观察到与之相关的副作用。这项研究证实,MSCs的治疗作用是通过其免疫调节活性,调节CD4+T细胞、促进Treg和辅助型T细胞2(Th2)发育以及抑制Th17和滤泡辅助T细胞(Tfh)的炎症反应。报道提示:MSCs移植可以显著增加干燥综合征患者的唾液流率,改善临床症状,并抑制炎症反应,当然,不是所有原发性干燥综合征患者都适合采用间充质干细胞治疗,通常需要对病情进行适当的评估,才能作出正确的判断。
▉ 自身免疫性肝病(AIH)
自身免疫性肝病(AILD)是一类由自身免疫反应异常导致肝细胞和/或胆管上皮细胞损伤的慢性肝胆系统炎性疾病,其临床表现按照其病理学和发病机制可以分为三类:自身免疫性肝炎(AIH)、原发性胆汁性胆管炎(PBC)和原发性硬化性胆管炎(PSC)[1-4]。这三种AILD临床表现多样,其中疲劳、食欲不振、肝脏不适和巩膜黄染比较常见,并导致血液检查中肝功能指标异常。此外,与自身免疫性疾病最突出的特征一致,AILD患者会产生自身抗体。
AIH在女性发病率较高,组织学表现为高IgG、高自身抗体、界面性肝炎等,目前来看AIH的临床试验开展较少,其中一项适应性、多中心、Ⅱa期、多疾病临床试验(NCT02997878)正在进行,该试验由英国伯明翰大学发起,以探究单次输注人脐带血来源的MSC治疗PSC和AIH患者的安全性和药物活性,但是最终临床试验结果尚未发布。
PBC已有2项完成的临床试验。2011年,由脐带来源的间充质干细胞(UC-MSC)是否以及如何改善PBC患者病情的临床试验(NCT01662973)开展。2013年发布试验结果:研究纳入7例对UDCA治疗反应不佳的PBC患者,每4周给予3次静脉输注(0.5×10的6次方/kg),随访48周。试验结果显示大多数患者经UC-MSC治疗后,疲劳、瘙痒等症状明显缓解。与基线相比,随访结束时ALP和GGT水平显著降低,梅奥风险评分在治疗和随访期间保持稳定,并且UC-MSC治疗未见明显副作用。
2014年的一项临床试验评估了异基因骨髓来源的MSC移植(BM-MSCT)治疗UDCA耐药的PBC患者的安全性和有效性,10例入组患者均被允许同时继续之前的UDCA治疗。在MSC输注后1、3、6、12个月进行随访评估。随访结束后,未观察到与移植相关的副作用,BM-MSCT后患者的生活质量得到改善。BM-MSC输注后血清ALT、AST、GGT和IgM水平较基线显著降低。外周淋巴细胞亚群中CD8+T淋巴细胞比例降低,CD4+CD25+Foxp3+T淋巴细胞比例增加,血清IL-10水平升高。值得注意的是,BM-MSC治疗后3~6个月获得最佳治疗效果,并可维持12个月。结论是异基因BM-MSC治疗UDCA耐药的PBC患者是安全有效的。
PSC是一种罕见疾病,在普通人群中患病率为6/10万~16/10万人,其特点是损伤肝内和肝外的大胆管,导致胆道狭窄和扩张,是一种涉及肝内和肝外胆管的炎性纤维化疾病,最终导致胆汁性肝硬化和门静脉高压。目前尚无有效的治疗方法。在严格的标准下,肝移植是合并终末期肝病(肝细胞癌或胆管癌)PSC患者的一种选择,肝移植术后10年复发的风险约为20%。但目前没有看到间充质干细胞治疗PSC的临床试验数据。
4理性看待间充质干细胞干细胞技术让传统医疗手段无效的患者重新燃起希望,但干细胞治疗也犹如开启了“潘多拉魔盒”,人们充满了好奇、期待和恐惧。
MSCs:有魔力的神药
随着MSCs临床研究的飞速增长,我们对MSCs基础知识的认识不足逐渐凸显出来,这限制了对其生物学功能的全面了解。
2018年,国际顶级学术期刊《自然》有这么一篇评论“Clear up this stem-cell mess(清理干细胞的混乱)”,Douglas Sipp等人指出:间充质干细胞给大众造成了一种万所不能的万金油印象,加上一些媒体的肆意吹捧,间充质干细胞变成一种“有魔力的、人人都能接受的神药”,成为商家向公众进行“干细胞干预”的首选细胞类型。
虽然临床前研究显示,MSCs能够促进功能恢复,但大多数临床研究仍处于早期阶段。到目前为止,在全球范围内只有少数MSCs治疗的商业产品获得了监管机构的批准。
质量控制问题
对于临床应用,必须保证MSC治疗的安全性。循环系统输注(动脉或静脉输注)MSCs相对安全,但也存在诱发肿瘤、炎症反应和纤维化的风险(Fitzsimmonset al., 2018)。由于MSCs可以抑制免疫系统,并促进新血管的形成,这可能会造成肿瘤的生长和转移。在修复过程中,纤维化反应也可能发生,因为MSCs也可以分化为成纤维细胞。研发人员必须克服MSCs规模化生产的障碍。由于MSCs细胞群具有异质性,因此不同的适应症需要不同的制备工艺。同样,由于每个临床应用都需要一个定制的、个性化的工艺流程,生产这些细胞产品的成本很高。质量控制标准共识的缺失,也阻碍了细胞制备工艺的标准化进程,评估产品的安全性和有效性仍然具有挑战性。长时间体外培养,也可能导致细胞出现基因变异或染色体异常。通常,MSCs在衰老前,可在体外进行20~40倍扩增(注意:这里指的是倍增次数,不是细胞代次。细胞代次在细胞药物开发方面没有重要意义)。此外,应使用化学成分明确的无血清培养基,避免使用动物血清产生相关的免疫反应。最后,研究人员必须确保细胞产品完全没有污染,包括微生物污染。对微生物的检测,始终应贯穿整个细胞制备过程。 百变的干细胞
百变的干细胞间充质干细胞是一种“百变”细胞群,具有各种功能和显著的治疗潜力。然而,在“维护小组”被派往大规模修复受损组织之前,科学家们需要更好地弄清楚这些工作人员所拥有的工具。
参考文献:
1.Migration and homeostasis of regulatory T cells in rheumatoid arthritis. Front Immunol.2022; 13: 947636.
2.Ghoryani M, Shariati-Sarabi Z, Tavakkol-Afshari J, Ghasemi A, Poursamimi J, Mohammadi M. Amelioration of clinical symptoms of patients with refractory rheumatoid arthritis following treatment with autologous bone marrow-derived mesenchymal stem cells: A successful clinical trial in Iran. Biomed Pharmacother. 2019;109:1834-1840
3.Petrou P, Kassis I, Levin N, et al. Beneficial effects of autologous mesenchymal stem cell transplantation in active progressive multiple sclerosis. Brain. 2020;143(12):3574-3588
4.Zhang J, Lv S, Liu X, Song B, Shi L. Umbilical Cord Mesenchymal Stem Cell Treatment for Crohn's Disease: A Randomized Controlled Clinical Trial. Gut Liver. 2018;12(1):73-78.
5. Yao G,Qi J,Liang J,et al.Mesenchymal stem cell transplanta-tion alleviates experimental Sjogren's syndrome through IFN-β/IL-27 signaling axis[J].Theranostics,2019,9(26):8253-8265
6.Xu J,Wang D,Liu D,et al.Allogeneic mesenchymal stem celltreatment alleviates experimental and clinical Sjogren syndrome[J].Blood,2012,120(15):3142-3151
7.中华医学会风湿病学分会,中国医院协会临床新技术应用专业委员会.异体间充质干细胞治疗系统性红斑狼疮专家共识[J].中华风湿病学杂志,2022,26(01):1-8.
https://kns.cnki.net/kns8/defaultresult/index
8. Tsokos G. C. (2011). Systemic lupus erythematosus. The New England journal of medicine, 365(22), 2110–2121.
9. Li, A., Guo, F., Pan, Q., Chen, S., Chen, J., Liu, H. F., & Pan, Q. (2021). Mesenchymal Stem Cell Therapy: Hope for Patients With Systemic Lupus Erythematosus. Frontiers in immunology, 12, 728190.
10.Tang, W. Y., Liu, J. H., Peng, C. J., Liao, Y., Luo, J. S., Sun, X., Tang, Y. L., & Luo, X. Q. (2021). Functional Characteristics and Application of Mesenchymal Stem Cells in Systemic Lupus Erythematosus. Archivum immunologiae et therapiae experimentalis, 69(1), 7.
11. Fathollahi, A., Gabalou, N. B., & Aslani, S. (2018). Mesenchymal stem cell transplantation in systemic lupus erythematous, a mesenchymal stem cell disorder. Lupus, 27(7), 1053–1064.
12.Liang, J., Zhang, H., Kong, W., Deng, W., Wang, D., Feng, X., Zhao, C., Hua, B., Wang, H., & Sun, L. (2018). Safety analysis in patients with autoimmune disease receiving allogeneic mesenchymal stem cells infusion: a long-term retrospective study. Stem cell research & therapy, 9(1), 312.
13.Gu, F., Wang, D., Zhang, H., Feng, X., Gilkeson, G. S., Shi, S., & Sun, L. (2014). Allogeneic mesenchymal stem cell transplantation for lupus nephritis patients refractory to conventional therapy. Clinical rheumatology, 33(11), 1611–1619.

谁持彩练当空舞 :干细胞基础与临床研究进展
— END —

