在生物医药领域,每一次新产品的获批都意味着无数科研人员与投资者的辛勤付出终于开花结果。近日,铂生卓越公司研发的艾米迈托赛注射液在中国和美国同期获得FDA(美国食品药品监督管理局)的批准,这一消息无疑为整个行业注入了一剂强心针。作为一名长期关注生物医药领域的财经博主,我认为这次获批不仅标志着中国在干细胞疗法领域取得了重大突破,更预示着未来生物医药市场的无限可能。
艾米迈托赛注射液的获批之所以具有里程碑意义,首先体现在其适用人群的广泛性上。虽然在美国,该药物主要用于2个月及以上的儿科患者,但在中国,它的适用人群已经扩展到了14岁以上的广泛人群。这意味着,更多的患者将有机会受益于这一创新疗法,从而在治疗过程中获得更好的疗效和生活质量。
除了适用人群的广泛性外,中国在细胞生产工艺上的先进性也是此次获批的一大亮点。艾米迈托赛注射液的生产采用了全封闭自动化的3D培养技术,相较于美国采用的手工工艺,这无疑是一种更为先进、高效且稳定的生产方式。这种技术的运用,不仅提高了产品的生产效率和质量稳定性,更为未来的大规模商业化生产奠定了坚实的基础。
从监管的角度来看,艾米迈托赛注射液的获批也具有重要的示范意义。细胞治疗产品作为一种新型药物,其研发和生产过程中往往没有现成的标准可循。因此,这类产品的审批往往面临着诸多挑战和不确定性。然而,通过企业和监管机构的共同努力,艾米迈托赛注射液最终成功获得了批准。这一过程中,企业不仅展示了其强大的研发实力和生产能力,更通过与监管机构的沟通协商,达成了一致的审批标准。这一成功案例,无疑为其他细胞治疗产品的审批提供了有益的借鉴和参考。

值得注意的是,艾米迈托赛注射液获批的适应症是移植物抗宿主病(aGVHD),这是一种异基因造血干细胞移植术后的主要并发症,严重时可能导致患者死亡。该药物的上市,将为医生提供更多有效的治疗手段,从而帮助患者更好地应对这一严重并发症。同时,作为处方药在医院凭医生处方使用,艾米迈托赛注射液的上市也将进一步推动中国生物医药市场的规范化发展。
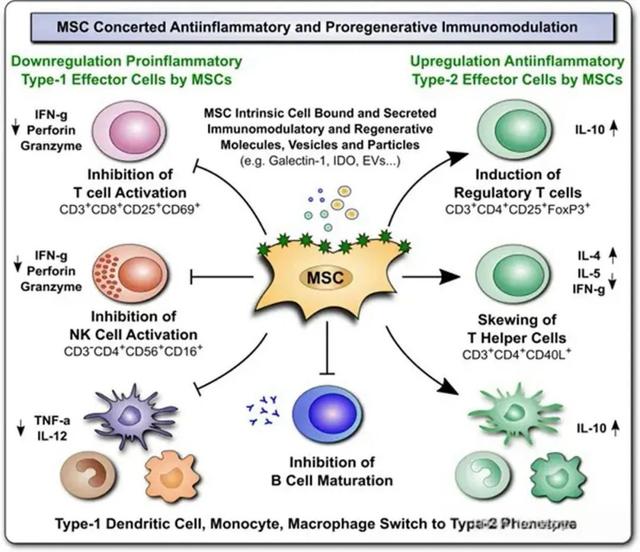
在艾米迈托赛注射液的获批背后,是中国生物医药产业的快速发展和不断创新。近年来,中国在干细胞疗法领域取得了显著进展。据国家药监局药品审评中心副主任王涛公开表示,从2017年至今,中国已经批准了100多款干细胞药物进入临床试验阶段,适应症涵盖了血液系统、呼吸系统、心血管系统以及自身免疫系统疾病等多个领域。这一数据不仅展示了中国在干细胞疗法领域的强大研发实力,更预示着未来这一领域将迎来更多的创新和突破。
然而,在干细胞疗法领域,除了间充质干细胞这一技术路径外,诱导性多能干细胞(iPSC)技术也备受关注。多位行业专家在接受采访时表示,iPSC技术具有更为广泛的应用前景和更为强大的治疗潜力。仅在2024年11月,就有两家iPSC领域的企业获得了融资,这进一步证明了市场对这一技术的看好和期待。
综上所述,艾米迈托赛注射液的获批不仅是中国干细胞疗法领域的一次重大突破,更是整个生物医药产业发展的重要里程碑。这一成功案例不仅展示了中国在生物医药领域的创新实力和监管水平,更为未来的产业发展提供了有益的借鉴和参考。
展望未来,随着干细胞疗法技术的不断进步和市场的不断扩大,我们有理由相信,中国生物医药产业将迎来更加美好的明天。作为投资者和消费者,我们也应该积极关注这一领域的最新动态和成果,共同推动中国生物医药产业的持续健康发展。