
编者按:细胞凋亡是生物体正常发育和维持稳态的重要过程。生理状态下,它参与了发育过程中非必要结构的退化以及多余细胞的清除;病理状态下,细胞凋亡调控的异常促进了肿瘤、神经系统以及自身免疫性疾病的发生,并与放化疗抵抗相关,因此针对肿瘤细胞凋亡逃逸的研究已成为当下的热门。
本期「专家组稿」由复旦大学附属眼耳鼻喉科医院王孝深教授担任执行主编,与复旦大学附属肿瘤医院许婷婷教授分享IAP抑制剂研究进展,为医者和患者提供更多参考。
专家介绍

王孝深
复旦大学附属眼耳鼻喉科医院放疗科主任医师、博士研究生导师
上海市抗癌协会鼻咽癌专业委员会副主任委员
肿瘤影像与康复治疗专家委员会副主任委员
中国抗癌协会鼻咽癌专业委员会常务委员
中国医师协会头颈肿瘤专业委员会常务委员
中国临床肿瘤学会鼻咽癌专家委员会常务委员
中国医药教育协会头颈肿瘤专委会常务委员
中国抗癌协会鼻咽癌整合康复专委会常务委员
上海市抗癌协会理事
中国临床肿瘤学会头颈肿瘤专家委员会委员
中国抗癌协会头颈肿瘤专业委员会委员

许婷婷
复旦大学附属肿瘤医院
副主任医师、博士
中国抗癌协会鼻咽癌专委会常委
CSCO头颈肿瘤专委会委员兼秘书
中华医学会鼻咽癌学组委员
国家癌症中心鼻咽癌质控专委会委员兼秘书
中国抗癌协会神经肿瘤专委会青年委员
上海市抗癌协会第二届青年理事会理事
《中国癌症志》第五届编委会青年编委
上海市医学会肿瘤放射治疗委员会青委兼秘书
题目:IAP抑制剂研究进展
◾ 王孝深 许婷婷 复旦大学附属眼耳鼻喉科医院/复旦大学附属肿瘤医院
细胞凋亡的途径可以分为caspase依赖性和非依赖性,其中caspase依赖性包括由受体配体结合起始的外源性途径(起始caspase 2,8,9,10可自我剪切;效应caspase 3,6,7需由其他caspase来剪切),以及促使线粒体释放细胞色素C等细胞因子,与Apaf-1结合后激活起始caspase-9再切割效应caspase-3的内源性途径;caspase非依赖性途径主要通过线粒体释放AIF和Endo G进入细胞核,切割核DNA诱导凋亡。caspase是一种蛋白水解酶,必须与相应的底物相结合以后才能发挥促凋亡的作用,它主要的效应包括释放DNA内切酶,失活DNA损伤修复酶PARP以及促进凋亡小体的形成。
一、凋亡抑制蛋白(Inhibitor of Apoptosis Protein, IAP)抑制剂放疗增敏的机制
凋亡抑制蛋白(Inhibitor of Apoptosis Protein, IAP)家族是一组凋亡负调控因子,包括8个家族成员,它的特征是在其肽链的n端存在至少一个杆状病毒IAP重复序列 (BIR)结构域。目前研究比较透彻的是XIAP、cIAP1和cIAP2,其中XIAP可以结合caspase-3、7、9直接发挥阻断作用,具有最显著的抗凋亡活性。而cIAP1、cIAP2则是通过抑制促凋亡复合物的形成,实现对凋亡通路的调控。三个IAP都具有三个BIR结构域,C端还具有RING结构域。RING具有泛素蛋白连接酶(E3)活性,通过泛素化凋亡调控因子,关闭细胞凋亡途径。
IAP与caspase CIAP-1和c-IAP2还具有caspase-recruitment domain (CARD)结构域,参与E3活性的调控。作为caspase的抑制剂,IAP一方面可以通过物理阻断掩盖caspase的活性位点,阻止底物进入,还可以靶向caspase蛋白酶体降解。其中XIAP是严格意义上唯一的直接caspase抑制剂,它的BIR3选择性地靶向caspase-9,而BIR2结构域及其连接子可以同时结合caspase-3和7,在凋亡抑制通路中发挥核心作用。cIAP则是通过RING结构域的E3连接酶活性,使caspases-3和-7的蛋白酶体降解。另外还参与了NF-kB通路的调控。
IAP与NF-κB信号通路 NF-κB家族包括五个成员,它们可以以二聚体形式被活化后促进下游的转录因子激活。经典NF-κB通路是在胞外刺激(射线、药物,配体受体结合,TNFα)的作用下,使IKK(IkB激酶复合物)激活,IkB蛋白降解,释放NF-κB二聚体,转移至细胞核,促进目的基因转录。而非经典 NF-κB 通路则是通过激活NIK,磷酸化IKKα使p100转化为p52,产生激活的NF-κB复合物,转移到细胞核并诱导下游基因表达。IAPs是NF-κB信号通路的关键调节因子。cIAP通过对RIPK1的泛素化降解,限制了促凋亡复合物II的形成,促进复合物I形成,激活促存活的经典NF-κB。另外,cIAPs还能使NIK发生泛素化降解,阻断非经典通路的激活,抑制炎症细胞因子如TNFα的释放。反过来,IAPs的缺失导致促凋亡复合物II的形成并激活caspase8介导的凋亡,同时通过NIK的积累,激活非典型通路,促进炎症因子的释放。IAP抑制剂能通过竞争性结合IAP的BIR结构域,来解除IAP对caspase的抑制作用,成为目前最被看好的靶向凋亡的药物之一。
IAP与Smac蛋白 人体存在非常微妙的平衡,在体内发现了一种与IAP相互作用蛋白,称为第二线粒体来源的caspase激活因子Smac(Second mitochondria-derived activator of caspases),当细胞受到凋亡刺激时,线粒体释放Smac到细胞质,后者与IAPs结合,使其丧失抑制caspase活性的作用,从而促进细胞凋亡。Smac的作用除了中和IAP蛋白外,可以诱导IAP的E3链接酶活性,从而导致其自泛素化而降解。内源性SMAC蛋白与XIAP的BIR3的亲和力高于BIR2,因此对caspase9的解除作用更强。
但Smac作为一种较大的蛋白质,在临床使用时可能会产生严重的脱靶效应。研究发现,Smac N端的四肽序列AVPI是主要的与BIR结构域结合的部位,AVPI片段也是保留Smac抑制活性的最小片段,因此采用化学合成序列相似的小分子化合物Smac类似物(IAP抑制剂),也能达到抑制IAPs的目的。IAP抑制剂可同时阻断XIAP和cIAP,通过促凋亡和抑制NF-κB通路两方面发挥抗肿瘤作用。放疗主要通过诱导凋亡(间接作用)和抑制有丝分裂(直接作用)发挥抗肿瘤作用,诱导凋亡在放疗抗肿瘤机制中占重要地位,而化疗可能更多依靠抑制有丝分裂或其他途径(如抗代谢)。电离辐射可以通过降解IkB激活NF-κB经典通路,并诱导TNF-α上调,同时去除TRAF-2或cIAP-1可以激活由TNF-a启动的死亡受体通路从而诱导凋亡。研究显示,Smac类似物SM-164可以增强辐射诱导的NF-κB,导致TNF-a转录和分泌增加,促使caspase-8激活。联合IAP抑制剂可以降低放射治疗诱导的细胞死亡的阈值实现放疗增敏。
Smac类似物的临床研究现状 目前已经进入临床研究阶段的Smac类似物主要有两种类型,一种是单体抑制剂,其与IAP只有1个结合位点,能与cIAP-1/2 和XIAP的BIR3结构域结合,从而Caspase-9得以释放;另一种是二聚体抑制剂,有2个结合位点,能与cIAP-1/2的BIR3域以及与XIAP的BIR2和BIR3域同时结合,从而同时释放Caspase-3、7、9。实验证明二聚体具有更高的亲和力,但是单体可以口服,具有更高的生物利用度,而二聚体需要通过静脉注射给药。
表1.已进入临床研究阶段的IAP抑制剂
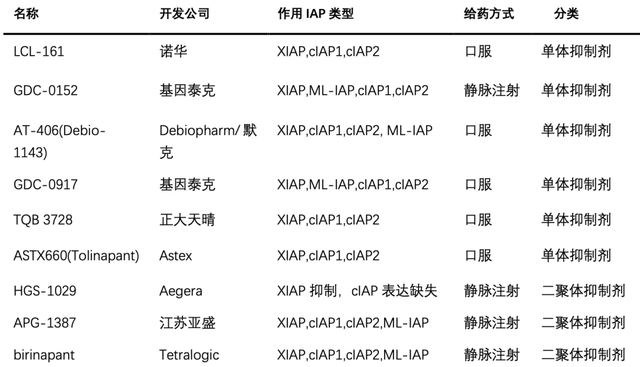
二、IAP抑制剂在实体瘤中放疗增敏的研究现状
IAP抑制剂在实体瘤中的探索方向主要是联合放疗用于头颈部鳞癌或鼻咽癌,在其他瘤肿中的研究包括和PD-1单抗或化疗联合。
表2.IAP抑制剂治疗实体瘤在研项目

目前在局部晚期头颈鳞癌中已经布局的IAP抑制剂与放疗联合的项目有4个,涉及的药物有2个:包括默克的AT-406(Debio-1143)和Astex制药公司的ASTX660。
作用机制 Debio-1143可阻断XIAP和cIAP1/2,从而解除凋亡抑制,抑制XIAP可直接释放内源性通路中下游的caspase活性,而抑制cIAP1/2可通过外源性通路促进TNF介导的促凋亡信号,肿瘤微环境中的TNF-α可以与之形成正反馈并放大凋亡信号,但外源性TNF-a的全身给药毒性非常大,使其无法得到推广。
联合化疗 Debio 1143的临床前研究显示其单药的抗增殖能力有限,而联合卡铂和顺铂能诱导头颈癌患者肿瘤样本产生caspase-3依赖性凋亡,认为Debio 1143联合化疗可能是一种潜在治疗方法。体外实验证明,放射治疗能诱导TNF-α的产生,反过来,TNF-α又增强辐射介导的杀伤。对药物和放疗的最佳联合模式的探索也证实Debio 1143与RT同步使用,并进行10天的维持,可以达到最佳疗效,因此提示临床应考虑与放疗同步联合辅助治疗。研究表明,Debio 1143联合RT在诱导肿瘤细胞凋亡的同时还伴随着TNF-a mRNA水平的显著升高,采用抗TNF-a抗体来中和TNF-a可以减弱联合治疗的抗增殖能力,强烈提示TNF-a在Debio 1143诱导的放射增敏中的作用。
临床研究 Xevinapant在局部晚期头颈鳞癌中与放化疗联合的2期RCT研究已经有长期阳性结果报道,在基于标准剂量顺铂CRT的基础上增加3周期的口服Debio 1143来增敏放疗,可使死亡风险下降53%。5年OS达到53%,接近标准CRT的2倍(HR 0.47, 95% CI 0.27-0.84, P=0.101)。在其III期的拓展队列研究中,方案在放化疗结束后又增加了三个周期单药的维持治疗,全球预计共入组700例,目前研究仍然在进行。另外一项针对具有高危因素的、铂类不能耐受患者的术后辅助放疗同步采用Xevinapant增敏的III期研究也在积极地入组中。
三、IAP抑制剂与免疫检查点抑制剂(ICIs)联合
早期的研究已经证明IAP和PD-L1能共同保护肿瘤细胞免受源自CD8+T细胞的促凋亡作用,两者的共同抑制作用显著提高了肿瘤细胞对细胞毒作用的敏感性阈值,是重要的耐药机制之一。由于IAP抑制剂对于IAP的阻断作用还受到TNF-α水平的影响,其会以TNF依赖的方式发挥作用,通过IAP抑制剂来调控cIAP蛋白一方面可以促进经典通路下caspase8依赖的凋亡,另一方面也可以通过泛素化降解消耗cIAP蛋白,使得非经典通路的核心蛋白NIK更稳定,进而激活非典型通路,进一步诱导TNF-α表达,参与自分泌/旁分泌,形成正反馈,并促进细胞进入死亡循环。有研究观察到当三阴性乳腺癌的肿瘤微环境中缺乏TNF-α时,肿瘤细胞将表现为对IAP抑制剂治疗耐药。基于这一理论,阻断PD-1/PD-L1可以增加效应细胞分泌TNFα的水平,因此ICIs可以和IAP抑制剂产生协同作用。
Cell杂志上发表的一项研究同样显示,ICIs、CAR-T细胞或溶瘤病毒可以诱导死亡的肿瘤细胞释放TNF,联合IAP抑制剂可以激活TNF自分泌信号通路,介导对于无抗原表达的肿瘤细胞的旁观者杀伤。另外,IAP抑制剂还具有调节先天和适应性免疫的作用,通过抑制cIAP1和cIAP2,激活非经典NF-κB通路,可以促进B细胞存活,激活树突状细胞,并向T细胞传递广泛的共刺激信号。也能使巨噬细胞从免疫抑制型M2型向促炎型M1分化,促进TNF-α分泌。
目前已有多项IAP抑制剂与ICIs联合治疗的临床研究,当然大部分还是在I期阶段(表3),在头颈癌领域的探索包括了在鼻咽癌中的江苏亚盛的APG-1387与特瑞普利单抗的联合以及局晚或转移SCCHN中的Birinapant与帕博利珠单抗的联合,但后者因为在结直肠癌队列已经达到无效终点而关闭了研究。
表3.IAP抑制剂与ICIs联合治疗研究

Clinical Cancer Research杂志今年发表的一项后线药物治疗晚期结直肠癌(CRC)和胰腺癌(PDAC)的研究,是首个有完整临床数据的报道IAP抑制剂和ICI联合用药研究,显示入组的40个患者中只有1个达PR,4个SD,且都是胰腺癌患者,有效率低。观察到cIAP-1表达水平在用药后显著降低,表明低于预期的疗效并非由于药物暴露不足导致。在大多数CRC患者中检测到caspase-3的激活,但在PDAC中却是相反的现象,提示IAP抑制剂的抗肿瘤作用在PDAC中存在的潜在代偿机制。类似的联合用药,在一项Xevinapant+O药治疗多瘤种的1b/2期研究中,显示ORR只有2.9%,另一项入组非小细胞肺癌的研究中采用Xevinapant+阿维鲁单抗,去年AACR会议上报道了ORR也只有10.5%,与历史数据对照,没有超过阿维鲁单抗的单药有效率。
尽管IAP抑制剂与ICIs联合具有良好的理论基础和临床前数据,但现有的临床试验结果仍然令人失望,初步报道均没有显示出两者联合能进一步提高治疗有效率。因此还需要进一步探索合适的联合时机、用药剂量以及是否需要其他疗法的参与。

版权声明
本文版权归医悦汇所有。欢迎转发分享,其他任何媒体如需转载或引用本网版权所有内容,须获得授权,且在醒目位置处注明“转自:医悦汇”。

