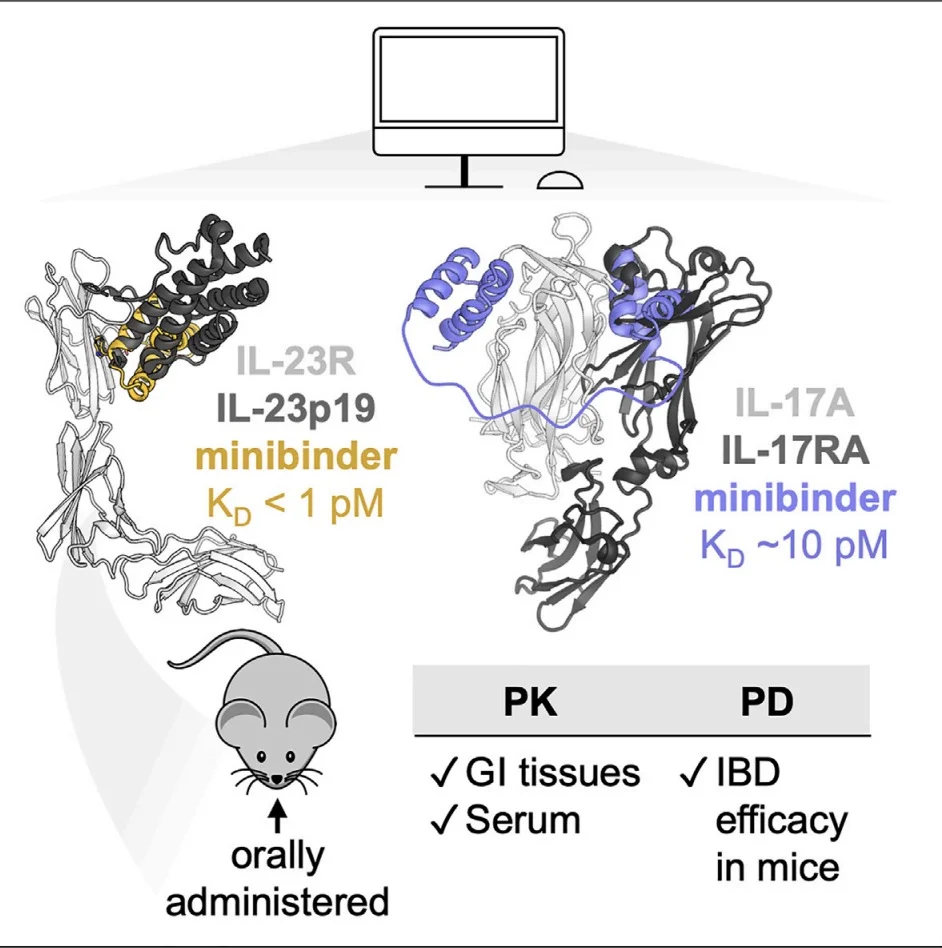
IL-23R和IL-17是自体炎症性疾病的关键治疗靶点,特别是在炎症性肠病(IBD)和银屑病的治疗中,抑制IL-23和IL-17的信号通路能够显著减轻炎症反应。然而,现有的抗体疗法存在不少局限。仅约30%的IBD患者在接受抗IL-23单克隆抗体(如Stelara)治疗后可达到缓解状态,且约20%的初始响应者会由于产生抗药抗体而逐渐失去响应。此外,系统性免疫抑制增加了患者患上恶性肿瘤和严重感染的风险。由于抗体分子较大且渗透性差,无法口服,只能通过静脉注射或皮下注射,这对患者而言既不方便又容易产生压力。
2024年6月,蛋白质设计领域大David Baker又有突破性进展,团队在Cell发文,通过蛋白质设计开发出具有口服活性的拮抗IL-23R和IL-17小蛋白,是人工智能在大分子设计领域的又一突破。研究团队通过计算设计,成功设计出具有抗体水平的低皮摩尔亲和力和极高稳定性的IL-23R和IL-17微结合蛋白,这些小蛋白不仅能够有效阻断细胞信号传导,而且在加热、酸和蛋白水解条件下表现出极强的抵抗力。
设计的IL-23R和IL-17小蛋白结合剂不仅具备低成本和易制造的优势,还可以通过口服途径达到治疗效果。在小鼠结肠炎模型中,口服的IL-23R微结合蛋白的疗效甚至优于临床使用的抗IL-23抗体。该研究展示了口服给药的去新设计微结合蛋白能够穿越肠上皮屏障并达到治疗靶点,具有高效力、肠道稳定性和简便制造的优点,为口服生物制剂提供了一种新的潜在模式。
在小鼠结肠炎模型中,口服的IL-23R微结合蛋白在缓解结肠炎症状方面表现出显著的疗效。药代动力学研究表明,这些微结合蛋白在大鼠体内具有良好的药代动力学特性和分布特点,能够穿越肠上皮屏障并到达目标组织。具体数据如下:单剂量口服20 mg/kg的23R-91在健康大鼠的肠道组织和内容物中的浓度分别为50-100 nM和40-200 nM,而在结肠组织中的浓度为2-20 nM。此外,在给予单剂量140 mg/kg的23R-91后,其在大鼠血清中的浓度在15分钟后达到峰值73 nM,随后迅速下降,半衰期约为15分钟。未来,随着更多临床前和临床研究的深入开展,这些微结合蛋白有望带来更加安全、有效和便捷的治疗选择。