如今,人们正试图用人工智能模拟人类的长期记忆。但问题是,我们至今仍无法完全解释人类最基本的记忆机制。
一段童年回忆为何能存储数十年而不消失?
我们能否精准删除某段特定的痛苦回忆?
长期记忆背后的分子机制到底是什么?
一般认为,我们人类的长期记忆与电子设备中的数字存储不同,是通过生物分子开关、突触与神经环路的动态变化来实现的。这种存储机制的优雅程度,远超人类目前所能设计的任何系统。
一、长时程增强现象(LTP)的发现
20世纪70年代,科学家们发现了长时程增强现象(long-termpotentiation,LTP)[1]。科学家们发现,电刺激连接两个神经元的突触会导致该连接传输信号的能力长期增强。当一个神经元的突触前膜持续、高频地向突触后神经元发送信号时,会导致突触后神经元的突触强度增加。这种变化可以持续数小时甚至数天,使得神经元之间的连接更加有效,从而增强信息传递的效率和稳定性。
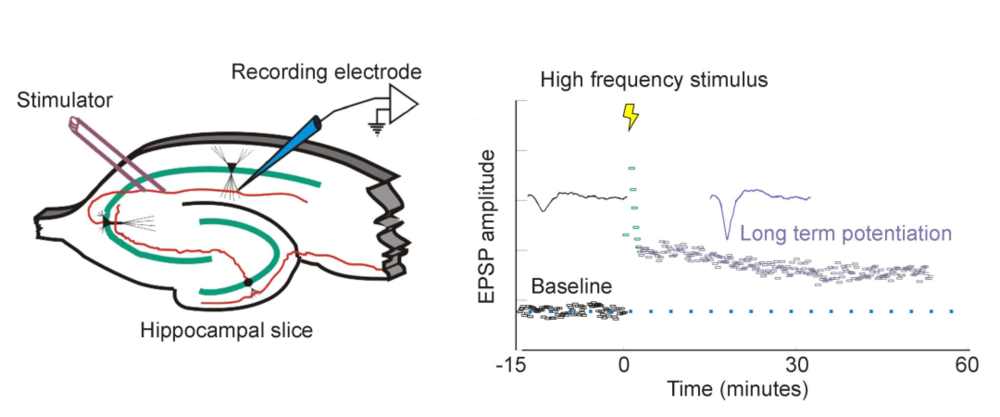
▷图源:WIKIMEDIACOMMONS
记忆的形成和存储,是神经元之间连接强度变化的结果,这种变化被称为突触可塑性。LTP等现象表明,神经元之间的连接强度可以通过学习和经验被增强,从而形成持久的记忆。记忆并非存储于单个神经元,而是分布在大脑的神经网络中,这些网络由神经元及其突触连接构成,形成了记忆的物理基础。记忆的编码、存储和检索过程涉及信息元素之间的关联被加工并编码为神经元之间的连接强度和突触结构,最终储存在分布式的神经网络中。
由此,LTP被广泛认为是记忆形成的关键过程,不同强度的神经连接网络被认为是记忆的构成。
二、记忆分子的探索
随着LTP的发现,新的问题也出现了,长期记忆背后的秘密又是什么呢?
科学家们假设可能存在某些分子,能够维持突触水平的长期变化。为此,他们试图探寻脑内与记忆直接相关的物质的存在——基于突触可塑性和分子机制,记忆的形成和维持可能依赖于这些特定的分子,这些分子能够在突触水平上调控神经信号的传递效率。

▷图源:[2]
2006年的一项研究显示,阻断PKMzeta/PKMζ(一种蛋白激酶)可以抹去大鼠对特定地点的记忆[2]。这一发现引起了广泛的关注,因为如果阻断一个分子可以抹去记忆,那么这个分子在记忆维持过程中必定扮演着关键角色。在记忆抹去实验中,阻断PKMzeta后,大鼠对特定训练环境的记忆被抹去,这表明PKMzeta在维持这些记忆中起着不可或缺的作用[2]。
随后的一系列研究也表明,PKMzeta不仅在大鼠中,而且在其他动物模型中也与记忆的维持密切相关。通过基因敲除和药物阻断等方法,科学家们进一步验证了PKMzeta在记忆维持中的关键作用。
然而,这一结论也存在“漏洞”。
首先,PKMzeta的作用时间较短。“这些蛋白质只在突触中持续几个小时,在神经元中可能持续几天”,参与2006年研究的共同作者、纽约州立大学下州健康科学中心的神经学家ToddSacktor疑惑:“然而我们的记忆可以持续90年,该如何解释这种差异”?
其次,PKMzeta是在细胞中按需产生的,但它必须定位到正确的突触。这项研究的另一位作者、纽约大学的神经科学家AndreFenton指出,每个神经元大约有10000个突触,只有少数几个被加强。特定突触的加强是这种机制存储信息的方式,但PKMzeta分子是如何实现这一点的尚不清楚。
三、追溯记忆的本质:PKMzeta与KIBRA的相互作用
18年后,Sacktor、Fenton及其同事2024年在ScienceAdvances杂志上发表的新研究,填补了这些漏洞[3]。

▷图源:[3]
这项最新研究表明,PKMzeta与另一种名为KIBRA(一种在肾脏和大脑内表达的适配蛋白)的分子协同发挥作用,KIBRA会附着在学习过程中激活的突触上,有效地“标记”这些突触,然后通过与PKMzeta结合,使这些被标记的突触得到强化。
KIBRA蛋白,即为“kidneyandbrainexpressedadaptorprotein”的缩写,又可称为WWC1,是一种在人类记忆中起重要作用的突触后支架蛋白,它被认为是一种“记忆粘合剂”。KIBRA可能以“突触标记”形式,附着在学习过程中被激活的突触上,在LTP的诱导阶段捕获PKMzeta并维持其活性,如此确保只有被PKMzeta激活的突触能够被加强。
实验表明,阻断这两种分子之间的相互作用,会消除神经元中的LTP并破坏小鼠的空间记忆。这两种分子的存在时间都很短,但它们的相互作用却能持续存在。“维持记忆所需的不是PKMzeta,而是PKMzeta与名为KIBRA的靶向分子之间的持续相互作用。”Sacktor说,“如果阻断PKMzeta与KIBRA的连接,一个月前的记忆就会消失。”他补充说,在这一个月里,特定分子已经被替换了很多次。但是,这种相互作用一旦建立,就会随着单个分子的不断补充而长期保持记忆。
这项研究不仅为“定位”提供了思路,还为PKMzeta存在时间问题给出了可能答案。更重要的是,这项研究提示,维持记忆的不是单个PKMzeta分子,而是PKMzeta与KIBRA之间的持续相互作用。其他研究也发现,在人类中,KIBRA基因的不同变体与记忆力的好坏有关,动物实验中干扰KIBRA则会破坏记忆。借助可视化技术,研究人员发现KIBRA和PKMzeta之间的紧密相互作用在其刺激的突触中有所增加,这大概就是增强PKMzeta能够增强记忆的原因。
这些研究结果推动了突触标记假说的理论发展,但也遭到了一些质疑。
2013年一项研究发现,缺乏PKMzeta的转基因小鼠仍可以形成长期记忆,因此质疑PKMzeta是否是海马区突触可塑性、学习和记忆所必需的[4]。
对此,Sacktor和Fenton给出了解释:在从出生起就缺乏PKMzeta的动物体内,存在另一种相关蛋白PKCiota/lambda代替了PKMzeta的工作。在正常动物的突触中,PKCiota/lambda的数量很少,而且很容易降解,但在缺乏PKMzeta的小鼠中,PKCiota/lambda的数量大大增加。
这项研究还发现,此前证明可以阻断PKMzeta的抑制肽ZIP也能阻断PKCiota/lambda。由此也引发了对PKMzeta的新一轮质疑——ZIP似乎并不像最初认为的那样具有特异性,它被认为可能还会抑制大脑活动。
而很快出现的新证据就打消了这些质疑。研究人员使用了两种不同的分子来阻断PKMzeta和KIBRA的相互作用,这两种阻断方法都只能阻止PKMzeta附着到KIBRA上,但不能阻止PKCiota/lambda附着到KIBRA上。实验表明,这两种阻断方法都能逆转正常小鼠的LTP和破坏记忆,但对缺乏PKMzeta的转基因小鼠的记忆存储没有影响。
结果表明,在正常动物体内阻断PKMzeta会抹去记忆,而阻断PKCiota/lambda则不会。因此认为,PKCiota/lambda在正常情况下对长期记忆的存储可能并不那么重要。Fenton和Sacktor认为,PKCiota/lambda是一种进化遗物(evolutionaryrelic),很久以前曾参与了记忆的进化;而PKMzeta作用更强,因此取代了PKMiota/lambda。但当在实验动物中敲除PKMzeta基因时,则会用到PKMiota/lambda的补偿作用[5]。
四、记忆研究的未来方向
目前,科学家们还在计划进一步探索这种相互作用背后的机制,以及神经元上强化的突触的分布情况。
正如Fenton的猜测:“它们是全部集中在一起,靠近细胞体,还是随机分布?找到这个问题的答案,也许能为阿尔茨海默病等记忆损伤疾病的治疗提供参考。”
Sacktor则表示,作为一名神经学家他已经看到了这项工作对治疗的影响:“我越来越看到通过基因疗法直接在神经元中植入蛋白质的可能性。而可以消除记忆以治疗创伤后应激障碍(PTSD)的药物,则比较难以想象。”
https://www.scientificamerican.com/article/brain-scientists-finally-discover-the-glue-that-makes-memories-stick-for-a/
参考文献:
1.Bliss,T.V.,&Lomo,T.(1973).Long-lastingpotentiationofsynaptictransmissioninthedentateareaoftheanaesthetizedrabbitfollowingstimulationoftheperforantpath.TheJournalofphysiology,232(2),331–356.https://doi.org/10.1113/jphysiol.1973.sp010273
2.Ling,D.S.F.,Benardo,L.S.,&Sacktor,T.C.(2006).ProteinkinaseMζenhancesexcitatorysynaptictransmissionbyincreasingthenumberofactivepostsynapticAMPAreceptors.Hippocampus,16(5),443–452.https://doi.org/10.1002/hipo.20171
3.Tsokas,Panayiotisetal.“KIBRAanchoringtheactionofPKMζmaintainsthepersistenceofmemory.”Scienceadvancesvol.10,26(2024):eadl0030.doi:10.1126/sciadv.adl0030
4.Volk,L.,etal.PKM-ζisnotrequiredforhippocampalsynapticplasticity,learningandmemory.Nature493,420–423(2013).https://doi.org/10.1038/nature11802
5.PanayiotisTsokas,etal.CompensationforPKMζinlong-termpotentiationandspatiallong-termmemoryinmutantmice.eLife5:e14846.https://doi.org/10.7554/eLife.14846