转自:生物谷

其实,果糖已经风靡了近半个世纪,这是一种天然存在于水果和蜂蜜中的甜味剂,也是高果糖玉米糖浆的一种成分,如今常常被添加在奶茶中作为重要的“甜味来源”。既往研究主要认为果糖通过“细胞自主机制”(cell-autonomousmechanism)直接促进肿瘤生长,肿瘤细胞能够利用果糖转运蛋白(如GLUT2和GLUT5)将果糖作为能量和生物质的来源,支持其代谢和增殖。
然而,近日Nature发表的一项最新研究却颠覆了以往关于果糖直接促进肿瘤生长的观点,揭示果糖通过肝脏代谢生成溶血磷脂酰胆碱(LPC)等营养物质,间接促进肿瘤生长,而非直接作为肿瘤细胞的能量来源。也就是说,果糖自己不“干活”,靠肝脏这位幕后操盘手,促进肿瘤生长。谁能想到,一杯奶茶背后竟藏着这么一出“甜蜜陷阱”呢?

甜得不简单!果糖成肿瘤“加速器”
为了探讨果糖对肿瘤生长的促进作用,研究团队动用斑马鱼、小鼠和裸鼠大军,精心设计了一系列实验。
首先,实验从斑马鱼黑色素瘤模型着手。这些斑马鱼可是“特殊选手”,携带有人类BRAFv600E致癌基因和p53缺失,简直“癌气逼人”。实验组斑马鱼被放置在果糖水中,而对照组则在普通水中生长。结果两周后,实验组的斑马鱼肿瘤明显增大,而对照组斑马鱼未被观察到任何肿瘤生长。这一结果初步证实,果糖能够促进黑色素瘤的生长。
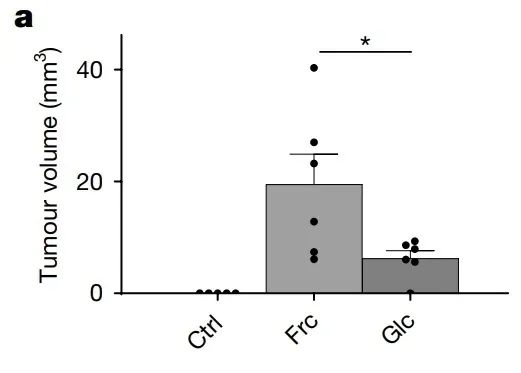
在对照水和含果糖的水中,观察2周后,BRAFV600E/p53斑马鱼肿瘤再生长的情况
接下来,为了验证这一发现是否适用于哺乳动物模型,研究者给小鼠植入300,000个BrafV600E突变、Pten缺失的黑色素瘤细胞,再让实验组小鼠饮用20%的高果糖玉米糖浆(HFCS),对照组则老老实实饮用普通水。结果与斑马鱼黑色素瘤模型的实验保持一致,实验组小鼠的肿瘤生长速度显著快于对照组。
此外,为了探究果糖是不是只“偏爱”黑色素瘤,研究者决定“换道实验”,乳腺癌、宫颈癌模型统统安排上!他们分别在小鼠乳腺脂肪垫中植入E0771乳腺癌细胞,宫颈部位植入表达HPV-E6/E7的TC-1细胞,还在免疫缺陷的裸鼠中植入了CaSki宫颈癌细胞。所有模型中,实验组小鼠的饮食均补充了HFCS,而对照组饮食则未含果糖。结果显示,无论肿瘤类型或位置,HFCS组的肿瘤生长均快于对照组。而且,就算在免疫缺陷的裸鼠身上,果糖的促癌效应仍然显著,表明其作用并不依赖于宿主免疫状态。

不过,研究者也没忘记挖掘果糖促癌的背后机制。他们测试了小鼠的体重、空腹血糖和胰岛素水平,看看果糖是不是通过引发代谢紊乱间接促进肿瘤生长。结果发现,与对照组相比,高果糖饮食组小鼠的这些代谢指标无显著差异。这表明,果糖促进肿瘤生长的机制独立于体重变化和代谢紊乱。换句话说,果糖压根儿没靠“代谢紊乱”作掩护,而是另辟蹊径,找了条独立的生物通路“搞事情”。
果糖是肿瘤细胞增殖的直接能量来源吗?
既然果糖已被观察到能促进肿瘤的生长,那肿瘤细胞是否直接利用果糖作为能量来源呢?于是,研究人员通过代谢组学分析和细胞增殖实验,探讨果糖是否能够直接支持肿瘤细胞的增殖。
首先是代谢组学标记实验,研究人员给果糖和葡萄糖分别贴上“身份标签”([U13C]标记)。然后,他们把这些“标签糖”喂给了各种肿瘤细胞,比如来自斑马鱼、小鼠和人类的癌细胞,看看肿瘤细胞到底更爱“吃”哪种糖。
结果一目了然:与葡萄糖相比,果糖的代谢效率极低。具体而言,葡萄糖广泛参与细胞代谢,其标记明显富集于乳酸中,而果糖的标记代谢物几乎没有检测到。换句话说,肿瘤细胞对果糖并不“感兴趣”,它们对果糖的直接代谢能力十分有限。
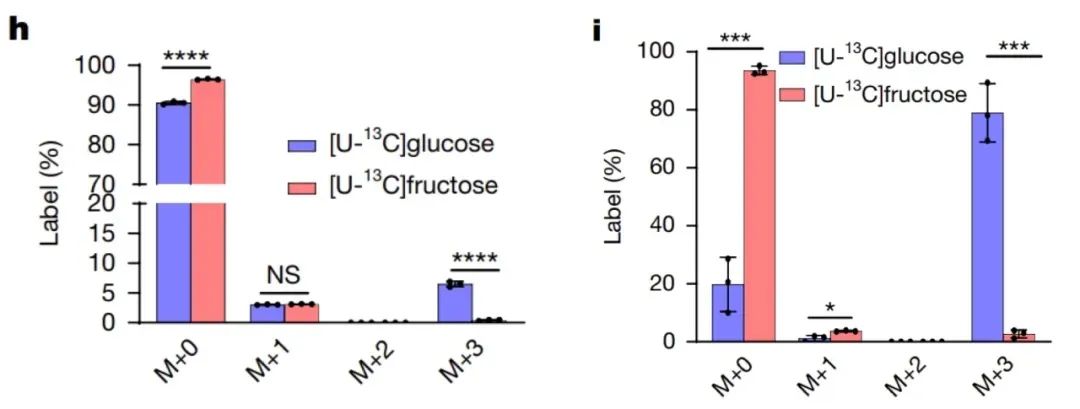
利用[U13C]标记的果糖和葡萄糖,追踪肿瘤细胞对两种糖的代谢情况
进一步的细胞增殖实验显示,果糖对肿瘤细胞增殖的支持作用也远弱于葡萄糖。在只有果糖的培养环境中,肿瘤细胞的增殖速度比在葡萄糖环境中慢得多,甚至接近完全无糖的培养环境。此外,研究者们还很细心地在葡萄糖的培养基里“加点料”——加入果糖,看看会不会出现“强强联合”的效果。然而结果再次让果糖“尴尬”:它不仅没有增强肿瘤细胞的增殖,反而像个“局外糖”,也未影响葡萄糖的代谢效率。
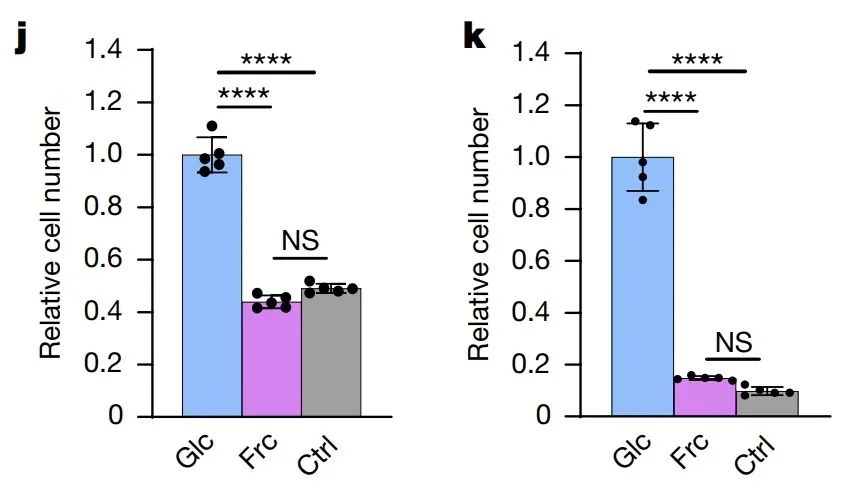
那果糖会不会通过某些隐秘的“捷径”支持肿瘤细胞增殖,比如多元醇代谢途径(把葡萄糖转化为果糖)?研究人员针对这个假设也展开了实验。结果发现,这一途径对肿瘤细胞增殖的贡献几乎可以忽略不计。
总体来看,实验结果清晰地表明,果糖并非直接支持肿瘤细胞增殖的重要能量来源。与葡萄糖相比,果糖的代谢效率较低,且对肿瘤细胞增殖的支持作用有限。在正常生理条件下,由于血液中的葡萄糖浓度远高于果糖,果糖在肿瘤代谢中的直接作用更加微弱。
肿瘤细胞为什么“冷落”果糖?
那么,果糖到底哪里不对劲?为什么肿瘤细胞“看不上它”?研究人员通过一系列体外实验,终于找到了答案——问题的核心竟然出在一种叫KHK(酮己糖激酶)的酶上。
当果糖进入细胞后,要想派上用场,首先得被转化成果糖-1-磷酸(F1P)或者果糖-6-磷酸(F6P),然后才能参与糖酵解,变成能量。但是在肿瘤细胞中,研究人员发现这一步几乎“卡壳”了。他们用“标记果糖”追踪它的代谢路径,结果只检测到少量的F1P,说明虽然肿瘤细胞中存在一定的KHK活性,但其效率非常有限,无法有效推动果糖代谢。
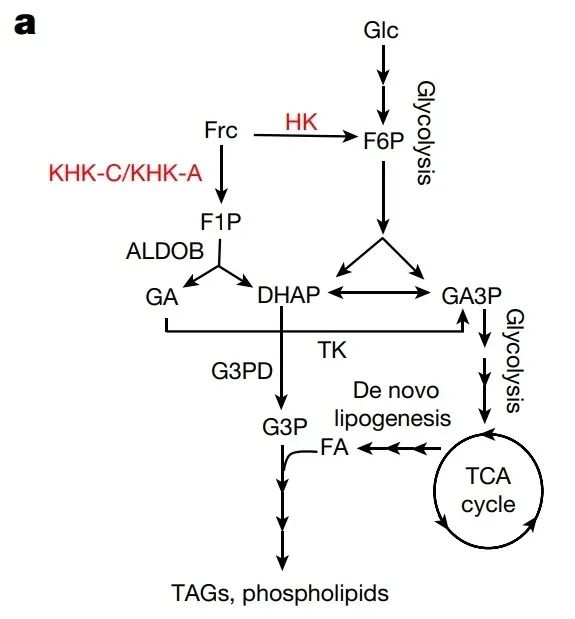
于是研究人员的目光集中到了果糖代谢的关键“工具”——KHK身上。那KHK是什么?为什么它如此重要?其实,这是一种专门处理果糖的酶,它有两种“工作模式”:
KHK-C是果糖代谢的关键酶,效率超高,主要在肝脏、肾脏和小肠中表达。
KHK-A是个“菜鸟”,效率低,对果糖的亲和力也很差。
正常生理情况下,肿瘤细胞喜欢用葡萄糖这个高效燃料,果糖虽然可以利用,但得看有没有KHK-C来“开路”。研究发现,肿瘤细胞里根本没有表达KHK-C,而只表达KHK-A,但其活性不足以支撑果糖的高效代谢。
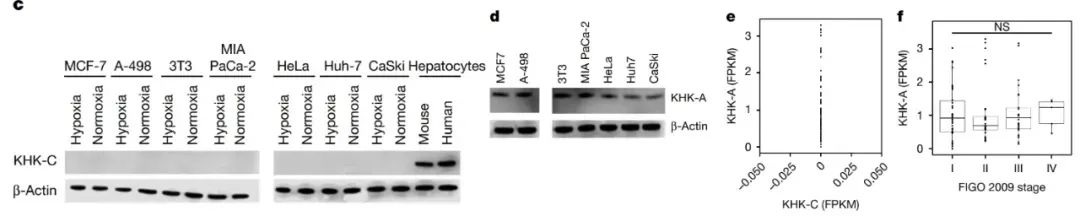
此外,肿瘤细胞中还缺乏醛缩酶B(aldolaseB),这一酶是将F1P转化为糖酵解中间产物的必要步骤。由此可见,肿瘤细胞中果糖代谢途径的多个关键环节均受到抑制。换句话说,肿瘤细胞对果糖处于“有心无力”的状态,即使有少量F1P生成,也没办法进一步进入代谢循环。
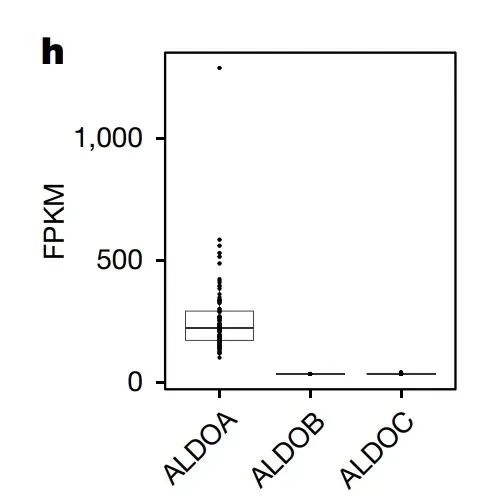
由此看来,果糖在肿瘤细胞中“失宠”的根本原因在于:
肿瘤细胞没有表达KHK-C这个果糖代谢“高手”,只依赖低效的KHK-A。
缺乏醛缩酶B,果糖代谢“卡在半路”,无法进一步转化为能量。
果糖“助攻”肿瘤肝脏当帮手
根据前文,已知果糖并不能直接被肿瘤细胞高效利用!那问题来了,为什么饮食中的果糖仍然可能推动肿瘤生长?原来,果糖对肿瘤细胞的“助攻”并非来自它自己,而是来自肝脏的代谢大转化!肝细胞等高表达KHK-C的组织能够将果糖转化为关键代谢物,通过代谢转移支持肿瘤细胞增殖。
为了验证这种代谢转移是否能支持肿瘤细胞的生长,研究人员设计了一个有趣的实验:将原代肝细胞和缺乏果糖代谢能力的宫颈癌细胞(CaSki细胞)共培养,并以果糖为唯一碳源。结果发现,与未共培养肝细胞的对照组相比,CaSki细胞的增殖速度显著提高。
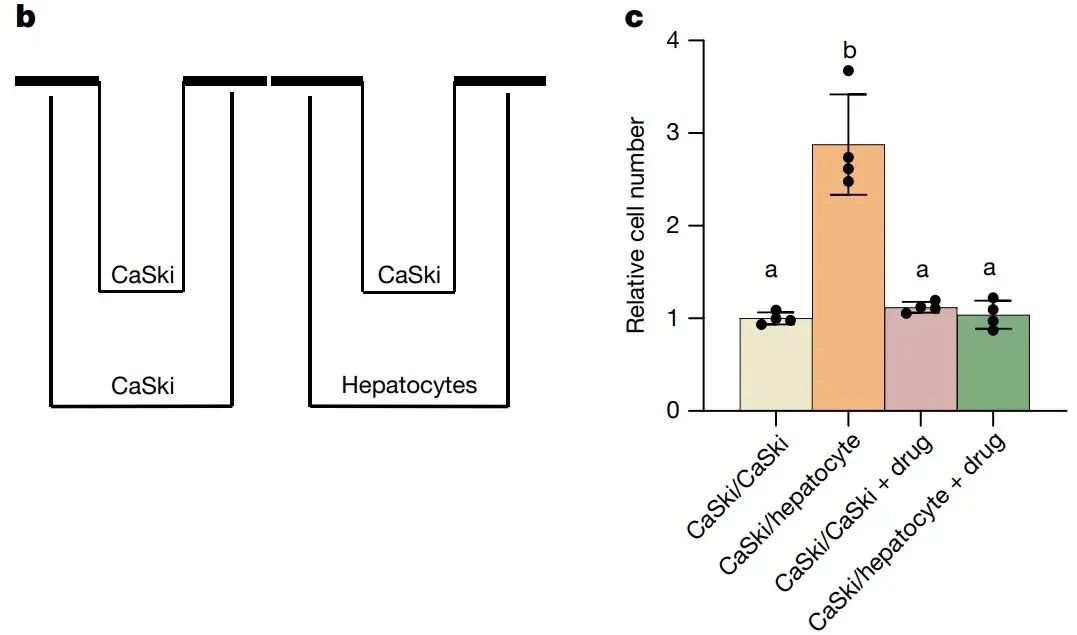
更有趣的是,当研究人员加入KHK-C的抑制剂时,这种增殖效应被显著抑制。这说明肝细胞正是通过代谢果糖为肿瘤细胞提供了“能量快递”,帮它们实现了快速增殖。
为了弄清通过果糖代谢生成了哪些支持肿瘤生长的营养物质,研究者们进行了代谢组学分析,发现肝细胞在富含果糖的培养基中释放了多种脂质代谢物,特别是不饱和溶血磷脂酰胆碱(LPC)。这个是什么呢?简单来说,LPC是一种高效能量分子,进入血液后,被肿瘤细胞吸收并转化为磷脂酰胆碱,这是细胞膜的重要“建材”,对肿瘤细胞的生长和增殖至关重要。
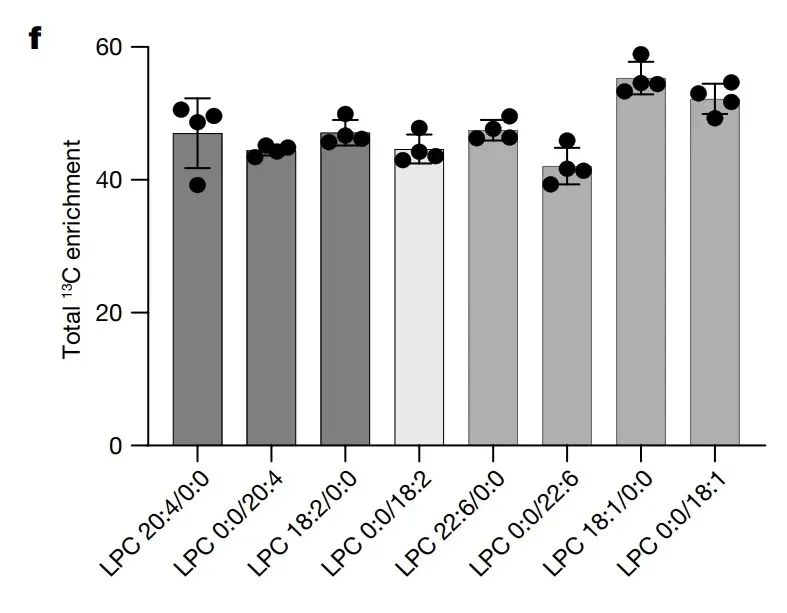
所以,这就相当于构建了一个“果糖-肝细胞-肿瘤细胞”的代谢联动模型。果糖在肝细胞中通过KHK-C被高效代谢,生成不饱和LPC等关键代谢产物;这些代谢物被肝细胞释放到微环境中,随后被肿瘤细胞摄取并利用,从而支持其增殖。
总的来说,这项研究说明果糖本身并不能直接让肿瘤细胞“狂吃猛长,但也别大意!高果糖饮食通过代谢产生一些中间产物(如LPC),这些代谢物能够被肿瘤细胞吸收利用,进而促进肿瘤的生长。因此,对于已经患有肿瘤或具有较高肿瘤风险的人群,减少高果糖食物(如含高果糖玉米糖浆的饮料和甜点)的摄入,可以降低果糖代谢间接推动肿瘤发展的风险。
所以,奶茶虽甜,千万别贪杯!你每喝下一杯奶茶,肿瘤细胞可能都在偷着乐:“谢谢老板又送来LPC大礼包!”特别是对肿瘤患者来说,那些隐藏的果糖“代谢黑手”才是大问题。下一次面对奶茶的诱惑,想想你的细胞们会不会因为你的“一时嘴爽”而被迫“加班干活”。健康的小船,可别让果糖掀翻啦!
参考资料:
Fowle-GriderR,RowlesJL3rd,ShenI,etal.Dietaryfructoseenhancestumourgrowthindirectlyviainterorganlipidtransfer.Nature.PublishedonlineDecember4,2024.doi:10.1038/s41586-024-08258-3
撰文|木白
