转自:生物谷
机体被同一病原微生物再次感染时,免疫系统能够通过比第一次应答更快、更强的免疫反应来控制感染、减轻或阻止疾病发展。这种免疫记忆力,主要依靠能识别该病原的淋巴细胞承载。理解免疫记忆如何产生,对于开发抗感染疫苗和治疗自身免疫性疾病都具有重要的理论和实践指导意义。
记忆B淋巴细胞(MemoryBcells,MBCs)是抗体免疫记忆的承载者之一,往往需要经历被称为“生发中心”的反应才真正能够发挥记忆功能。在“生发中心”里,高度集聚的B细胞高速增殖并反复经历基于亲和力的相互竞争和筛选。在竞争中胜出的细胞会被不断输出成为记忆B细胞和浆细胞,但这个过程背后的细胞发育和命运决定机制还很不清楚。

3月18日,来自清华大学医学院、基础医学院、免疫学研究所的祁海教授团队在《免疫》(Immunity)发表了题为“Aninterleukin-9-ZBTB18axispromotesgerminalcenterdevelopmentofmemoryBcells”的研究论文,首次报道了T细胞分泌的白细胞介素-9(IL-9)通过诱导转录因子ZBTB18表达,促进生发中心(GC)B细胞向记忆B细胞的定向分化与功能成熟。
祁海教授团队曾在2017年鉴定发现了来自生发中心的记忆B细胞前体(GC-MP),并首先报道白介素-9(IL-9)是推动生发中心B细胞发育成为MBC关键外在因素1。随后,该领域里有其它研究报道IL-9影响B细胞记忆功能。在本研究中,团队首先对比IL-9基因敲除(Il9-/-)与野生型(Il9+/+)小鼠的免疫应答。他们发现,尽管两者初次免疫后抗体水平无显著差异,但Il9-/-小鼠在二次抗原攻击后无法有效提升抗体滴度,表明IL-9缺失导致其二次免疫应答受损。
团队进一步通过过继转移实验将相同数量的NP抗原特异性Il9+/+或Il9-/-MBC分别移植至受体小鼠体内,发现Il9-/-MBC生成的浆细胞(PC)和生发中心(GC)数量显著低于野生型,证明IL-9对MBC功能具有内在调控作用。
接着利用B细胞特异性IL-9缺陷嵌合体模型(mMT:Il9-/-)证明了B细胞能否产生IL-9并不影响MBC的功能。相反,使用T细胞特异性IL-9缺陷嵌合体模型(Tcrb−/−Tcrd−/−:Il9-/-),他们发现,如果T细胞缺乏IL-9,这种环境里发育出的野生型MBC也无法有效参与二次应答,从而确立了IL-9在“T细胞教育MBC”模型中的核心地位。
进一步,作者通过筛选发现转录抑制因子ZBTB18在GC-MPs和MBCs中呈现上调的表达模式,且IL-9可通过STAT1途径上调ZBTB18。进一步实验表明,ZBTB18条件性敲除小鼠的GC来源MBCs数量显著减少。结合Smart-seq2、ATAC-seq和双荧光素酶实验,研究团队发现ZBTB18通过三重机制促进MBC的命运决定过程:抑制细胞周期基因(Cyclins、Cdks)以停止生发中心增殖而促进细胞进入静息状态;下调促凋亡因子(Bid、Casp3)以增进细胞存活能力;阻断GC滞留因子S1PR2以促进GC-MPs离开生发中心集聚态而成为MBCs。缺失ZBTB18时,IL-9对MBC发育的促进作用显著减弱,而强制表达ZBTB18可以挽救IL-9缺陷所导致的MBC发育缺陷。这些结果确立了“IL-9-ZBTB18轴”作为MBCs从生发中心发育而来的核心调控通路,充分且必要。
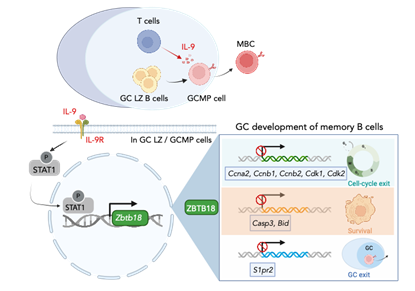
IL-9-ZBTB18信号轴促进记忆B细胞发育
祁海教授团队这一发现破解了B细胞免疫记忆形成的关键分子机制,为通过操控免疫记忆而强化疫苗、创新免疫治疗提供了新靶点。团队于2024年在《免疫》(Immunity)和《自然·免疫学》(NatureImmunology)期刊各发表一篇关于记忆B细胞的工作,分别报道了B细胞记忆的关键开关蛋白和再应答能力的第一个检查点2,揭示了记忆B细胞再分化时命运决定的表观遗传机制3。
与2017年发表在《自然·免疫学》的工作一起,这三个工作系统回答了B细胞免疫记忆领域最关键的三个问题:记忆B细胞如何发育而来、如何再激活、以及如何再分化的命运决定机制。
研究团队介绍
清华大学医学院、基础医学院、免疫学研究所祁海教授是该论文的通讯作者,医学院博士后罗晓翠、博士毕业生侯小筱为该论文的共同第一作者,昌平实验室王毅峰副研究员为该研究做出了重要贡献。研究项目得到了国家自然科学基金、昌平实验室、清华-北大生命科学联合中心、北京市科学技术委员会、北京生物结构前沿研究中心、山西医科大学-清华大学医学院协同创新中心、以及新基石项目的支持。
参考文献
1.Wang,Y.,Shi,J.,Yan,J.,Xiao,Z.,Hou,X.,Lu,P.,Hou,S.,Mao,T.,Liu,W.,Ma,Y.,Zhang,L.,Yang,X.,&Qi,H.(2017).Germinal-centerdevelopmentofmemoryBcellsdrivenbyIL-9fromfollicularhelperTcells.Natureimmunology,18(8),921–930.
2.Wang,Y.,Shao,W.,Liu,X.,Liang,Q.,Lei,J.,Shi,W.,Mei,M.,Li,Y.,Tan,X.,Yu,G.,Yu,L.,Zhang,L.,&Qi,H.(2024).HighrecallabilityofmemoryBcellsrequiresZFP318-dependenttranscriptionalregulationofmitochondrialfunction.Immunity,57(8),1848–1863.e7.
3.Shao,W.,Wang,Y.,Fang,Q.,Shi,W.,&Qi,H.(2024).EpigeneticrecordingofstimulationhistoryrevealsBLIMP1-BACH2balanceindeterminingmemoryBcellfateuponrecallchallenge.Natureimmunology,25(8),1432–1444.
(转自:生物谷)


![清华不愧是清华[作揖][作揖]](http://image.uczzd.cn/12268564184788686441.jpg?id=0)