前言
“慢加急性肝衰竭(ACLF)主题月评”是中国慢(加急)性肝衰竭联盟受《国际肝病》编辑部邀请,制作的ACLF相关学术月评专栏。本专栏每月以ACLF某一特定领域为主题展开,旨在普及ACLF的概念及意义、帮助读者快速了解有关领域的进展。希望本专栏对无论是需要了解相关领域热点的肝病专家及研究人员,或是需要实用知识、活跃于临床一线的医务工作者,均能有所裨益。
本期月评简要描述肝脏体积在乙肝相关慢加急性肝衰竭(ACLF)中的预测作用以及基于肝脏体积的ACLF预测模型。此外,还对本月(2024.7.21-2024.8.20)PubMed上更新的ACLF相关重要文献进行简评。

关于作者:
中国慢(加急)性肝衰竭联盟(Chinese Acute-on-chronic liver failure Consortium,Ch-CLIF-C)是由上海交通大学附属仁济医院消化内科李海教授牵头,由全国15家三甲医院感染科/肝病中心共同参与成立的肝病科研合作团队,致力于探索慢加急性肝衰竭(ACLF)的发病机制、制定基于高循证等级的乙肝高流行区ACLF诊断标准。目前团队开展了全球已报道入组数最多的ACLF前瞻性多中心队列研究“CATCH LIFE”(Chinese AcuTe-on-CHronic LIver FailurE),包含2个大型队列(入组2600的探索队列与入组1370例的验证队列)。
本期责任编辑

何英利
西安交通大学第一医院感染科党支部书记、主任,医学博士生导师、机械学博士生导师、主任医师、研究员。中华医学会感染病分会青年委员,陕西省医学传播学会感染病学分会主任委员,陕西省中西医结合学会传染病学分会主任委员,陕西省中青年科技创新领军人才。从事肝衰竭基础及临床研究,主持国家自然科学基金4项,国家科技部人才基金1项,主持陕西省自然科学基金2项,主持国际合作项目1项,已发表SCI论文52篇,其中作为第一作者或通讯作者发表22篇,单篇影响因子最高为10.539,发表中文核心期刊论文24篇。
副责任编辑

张巧
西安交通大学内科学在读博士生,师从西安交通大学第一附属医院何英利教授,目前主要研究方向为慢加急性肝衰竭的临床及代谢组学研究,曾在美国肝病学会年会进行壁报交流,研究成果被亚太肝病学会年会、中华医学会肝病学分会年会收录。
主题述评乙肝相关慢加急性肝衰竭(HBV-ACLF)病情进展迅速,短期死亡率高,早期准确地做出病情评估和临床结局预测对于优化肝移植时机、及时调整治疗策略从而提高生存率有重要临床意义。临床实践中可以观察到肝体积严重萎缩的肝病患者往往临床结局不佳。肝储备功能是评估肝损伤严重程度、判断患者预后的重要指标,形态结构决定其功能,肝贮备功能与肝细胞数量多少直接相关,肝脏体积大小从宏观上直接反映了肝细胞数量的变化。肝衰竭时肝细胞不同程度坏死和凋亡、肝组织萎缩、结构塌陷,引起肝脏宏观形态学变化,肝体积缩小[1]。因此,肝体积大小是定量客观评估肝病病情及判断临床结局的重要指标。监测患者临床症状、体征及生化检测指标的同时考虑其肝脏体积变化,有助于全面评估病肝储备功能状态、准确预测死亡风险以及合理制定诊疗方案。
目前常用肝衰竭预后模型CLIF-SOFA、CLIF-C ACLFs、COSSH-ACLFs、CTP、MELD评分等未将肝脏形态学指标纳入研究。在2022年,我们开展了一项关于肝脏体积与ACLF患者预后关系的多中心研究[2]。在该研究中,我们从2家医院的肝病科共纳入323例HBV-ACLF患者作为模型建立组,从其他5家医院肝病科共纳入163例患者作为外部验证组,分析了肝脏体积在HBV-ACLF患者28天生存中的预测作用,建立并验证基于肝脏体积的HBV-ACLF预后模型。结果如下:
不同预后患者肝脏体积
实测肝体积(LV)通过软件测量计算机断层扫描(CT)肝脏影像学资料得到。预估肝体积(ELV)计算公式为:ELV=203.3-[3.61×年龄(岁)]+[58.7×胸廓宽度(cm)]-463.7。
图1(a)是一例41岁的男性患者,其生存时间超过28天,LV为1172 cm3,ELV为1153.42 cm3,肝体积比(LV/ELV%)为101.61%;图1(b)是一例29岁男性患者,于确诊后第13天死亡,LV为618 cm3,ELV为1295.53 cm3,LV/ELV%为47.70%。

图1. CT测量肝脏体积
肝脏体积实际测量值一致性检验
通过组内和组间一致性检验,组内相关系数(ICC)=0.979,提示肝脏体积测量结果的一致性和可重复性良好。随机抽取50位患者的影像资料请另一位影像学专家再次独立测量,相关性分析显示两名肝脏影像学医师报告的肝脏体积测量值之间有密切的相关性(r=0.980,P<0.001)。两位影像学医师报告的肝脏体积测量值平均差值为-4.52 cm3(95%CI:-22.67~13.63 cm3),Bland Altman图中横轴表示两位影像医师测量每个患者肝脏体积的结果平均值,纵轴表示两人测量结果的差值百分比,两位影像医师测量结果的平均差值百分比为-0.45%(-2.09%~1.20%)。综合分析提示通过CT实际测量肝脏体积的方法具有良好的一致性和可重复性。

图2. 测量肝脏体积值Bland-Altman图
生存组和死亡组估算肝体积、实测肝体积、肝体积比比较
如图3(a)所示,ELV在生存组和死亡组间没有显著差异(1113.32 ± 15.74 cm3 vs 1102.59 ± 8.95 cm3,P=0.583),提示两组患者的基线肝脏体积大小无显著差异。图3(b)所示,死亡组的CT实测LV显著小于生存组[806.59 (578.38-1019.00)cm3 vs 1137.34(901.60-1371.27)cm3, P<0.001],提示死亡组患者的实际肝脏体积显著小于生存组患者,肝脏体积大小可能与HBV-ACLF 的短期死亡率有相关性。图3(c)所示死亡组LV/ELV% 为71.73%(55.07%-90.87%)显著低于生存组100.72%(89.62%-120.18%),P<0.001,提示死亡组HBV-ACLF患者肝体积萎缩变小更严重,疾病进展过程中肝脏体积萎缩变小的严重程度客观反映了肝脏细胞坏死、组织结构塌陷的严重程度,对患者的短期生存情况有重要影响。

图3. 生存组和死亡组估算肝体积ELV(a)、实测肝体积LV(b)、肝体积比LV/ELV%(c)比较
LV及LV/ELV%预测HBV-ACLF短期预后评估
如图4所示,建模组数据分析示LV/ELV%预测HBV-ACLF患者28天死亡率的AUC 0.835(0.789-0.873)显著高于LV的AUC 0.782(0.733-0.826,P<0.001)。提示肝体积比LV/ELV%对于HBV-ACLF短期死亡率的预测能力优于CT实测肝脏体积LV,是HBV-ACLF短期预后的一个重要预测因子。
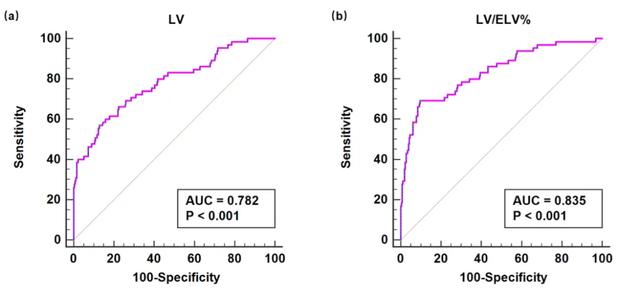
图4. LV(a)和LV/ELV%(b)对HBV-ACLF短期死亡率的预测(建模组)
影响HBV-ACLF短期死亡率的独立危险因素
Logistic 回归分析发现6个影响HBV-ACLF 28天死亡率的独立危险因素分别为:年龄(OR 1.035,95%CI:1.004-1.067;P=0.0273);肝性脑病(HE;II期OR 3.167,95%CI:1.197-8.375,P=0.0202;III期OR 16.622,95%CI:4.108-67.257;P<0.001);lnTBIL(OR 1.895,95%CI:1.004-3.577;P=0.0487);PT(OR 1.039,95% CI:1.002-1.078;P=0.0413);HBV DNA(OR 0.772,95%CI:0.642-0.929;P=0.0062)及LV/ELV%(OR 0.934,95%CI:0.915-0.954;P<0.001)。
构建预后模型及预测效能评估
基于以上6个独立危险因素构建的预后模型计算公式为:LEAP-HBV = - 0.0679 × LV/ELV% + 0.0345 × Age + 0.0381 × PT+ HE +0.6390 × ln[TBIL (μmol/L)] - 0.2583 × HBV DNA(lg IU/mL)- 0.8680,其中无HE时HE取0,轻度HE(I-II期)时HE取1.1527,重度HE(III-IV 期)时HE取2.8108。
如图5(a)校准曲线分析示,校准曲线斜率接近1,提示LEAP-HBV预测的HBV-ACLF 患者死亡概率与实际观测值一致性良好。如图5(b)所示ROC 曲线下面积AUC为0.909(95%CI:0.872-0.938),提示LEAP-HBV预后模型对于HBV-ACLF的28天死亡率具有较高的预测价值。Bootstrap法对模型进行内部验证,基于建模组的LEAP-HBV平均AUC为0.906(0.904-0.908),表明模型内部稳定性良好。图5(c)可见死亡组的LEAP-HBV评分显著高于生存组[0.62(-0.71–1.80)vs -3.19(- 4.62–-2.04),P< 0.001]。以LEAP-HBV的Cut-off值-1.71将建模组患者分为两组,如图5(d) Kaplan-Meier生存曲线示LEAP-HBV>-1.71的HBV-ACLF比LEAP-HBV<-1.71的HBV-ACLF预后明显更差(P< 0.001)。

图5. (a)LEAP-HBV预后模型的校准曲线;(b)建模组LEAP-HBV对HBV-ACLF短期死亡率的预测ROC曲线;(c)LEAP-HBV评分在生存和死亡患者间的比较;(d)不同LEAP-HBV评分预后比较的Kaplan-Meier 生存曲线
LEAP-HBV模型与其他预后模型对HBV-ACLF短期死亡率的预测性能比较
如图6(a)所示,在建模组中分别绘制LEAP-HBV预后模型、Chil-Pugh分级、MELD-Na评分、CLIF-SOFA评分、CLIF-C ACLF评分以及COSSH-ACLF评分预测建模组HBV-ACLF患者28天死亡率的ROC曲线,并通过Z检验进行AUCs的差异分析,LEAP-HBV模型AUC显著高于其他临床常用肝病预后模型的AUCs,差异有统计学意义(P<0.05)。如图6(b)所示外部验证队列HBV-ACLF患者28天死亡率的AUC高达0.820(0.710-0.920),提示模型的外部通用性良好。

图6. 建模组(a)、验证组(b)各预后模型对HBV-ACLF 短期死亡率预测的AUCs比较
总结本研究的发现总结如下:1)死亡组患者CT实测的肝体积(LV)和反映肝脏体积变化的肝体积比(LV/ELV%)更小,提示死亡组患者的肝脏体积萎缩变小更显著;2)肝脏体积是影响HBV-ACLF患者28天死亡率的独立危险因素,肝体积比(LV/ELV%)低的患者预示其临床结局不佳;3)基于全肝体积的预后模型LEAP-HBV对于HBV-ACLF的短期死亡率具有较高预测价值。
近1月ACLF的研究统计及简评2024.7.21-2024.8.20,PubMed上更新ACLF相关综述/述评及论著共22篇。涉及病因诱因、发病机制、诊断与定义、治疗、预测与预后等方面。

01
de Haan J, Termorshuizen F, de Keizer N, et al. One-year transplant-free survival following hospital discharge after ICU admission for ACLF in the Netherlands. J Hepatol. 2024 Aug;81(2):238-247.doi: 10.1016/j.jhep.2024.03.004. IF = 26.8
简述:在欧洲,慢加急性肝衰竭患者通常需要入住重症监护室(ICU)以获得器官支持。这些患者的短期死亡率很高,但其中存活者的长期结局仍然未知。本研究旨在评估慢加急性肝衰竭(ACLF)患者住院期间的死亡率以及出院后1年的无移植生存情况。
本研究来源于一项荷兰的全国性、观察性队列研究,研究纳入了3035名2012年至2020年因肝硬化病史或首次因肝硬化门脉高压并发症收入ICU的患者。在入住ICU时评估患者ACLF等级,其中1819人(59.9%)为ACLF-3级,1420人(46.8%)入住ICU后存活。出院后1年无移植生存总体概率为0.61(95%CI:0.59-0.64),该数值随入住ICU时ACLF分级而变化,无ACLF的患者最高(0.71;95%CI:0.66-0.76),ACLF-3级患者最低为0.53(95%CI:0.49-0.58,P<0.0001)。然而,在调整年龄、是否存在恶性肿瘤和MELD评分后,入住ICU时的ACLF等级与出院1年内移植或死亡风险增加并不相关。
简评:本研究通过荷兰全国性队列研究,发现了ACLF患者在入住ICU时的ACLF等级对出院后1年的无移植生存率并无独立影响。相反,患者的年龄、是否存在恶性肿瘤以及肝病的严重程度在影响出院后1年无移植生存率方面起着更突出的作用。该研究强调了在评估肝硬化危重症患者出院后长期预后时需考虑合并症的总体负担以及肝病的严重程度的重要性。然而,该研究仍存在一定的局限性,例如该研究使用的数据库最初并非为肝硬化患者设计,存在部分数据缺失,且采用了回顾性分析,可能出现偏倚。另外,该研究存在因同一名患者在不同医院住院而被重复纳入研究的可能,会导致观察的结局事件被高估。
02
Zeng F, Jiang W, Chang X, et al. Sarcopenia is associated with short- and long-term mortality in patients with acute-on-chronic liver failure. J Cachexia Sarcopenia Muscle. 2024 Aug;15(4):1473-1482.doi: 10.1002/jcsm.13501. IF = 9.4
简述:肌少症被认为是肝硬化死亡的预测因素,但其对慢加急性肝衰竭(ACLF)的影响仍不确定。尽管已有多项研究探讨了肌少症对ACLF患者短期死亡率的影响,但这些研究的样本量有限,结果也不一致。因此,本研究旨在探讨肌少症对ACLF患者短期和长期死亡率的影响。
本研究为回顾性队列研究,纳入了2016年1月至2022年9月接受治疗的414名ACLF患者。通过测量第三腰椎骨骼肌指数(L3-SMI)来诊断肌少症。414名患者平均年龄为52.88±13.41岁,其中男性318名(76.8%),肌少症239名(57.7%),研究期间共280名(67.6%)患者死亡。其中153名(37%)患者于28天内死亡,209名(50.5%)患者于1年内死亡患者。本研究发现肌少症组患者28天、1年和总体死亡率显著高于非肌少症组(37% vs. 22.3%,P<0.01;50.5% vs. 34.9%,P<0.01;67.6% vs. 53.1%,P<0.01)。多因素COX回归分析提示肌少症与死亡率增加显著相关。肌少症的28天、1年和总体死亡率的风险比(HR)分别为2.05(95%CI:1.41-3.00,P<0.01)、1.81(95%CI:1.29-2.54,P< 0.01)、1.82(95%CI:1.30-2.55,P<0.01)。另外,肌肉密度和INR与短期以及长期死亡率也相关。
简评:本研究发现肌少症与ACLF患者的短期以及长期死亡风险增加显著相关。因此对有肌少症的ACLF患者,尤其是对提高其长期预后方面,需优先考虑对其进行持续监测和护理。本研究提示系统地监测肌少症并对其进行干预来提高患者营养状况,可以改善患者整体预后。然而,该研究仍存在一些局限,首先本研究是回顾性研究,可能存在选择偏倚。其次,该研究未对患者L3-SMI水平进行动态评估,因此其动态改变对临床的价值尚不清楚。未来可进行前瞻性研究,动态测量L3-SMI水平,以评估肌少症动态变化对ACLF患者预后的影响。
03
Schwarz M, Simbrunner B, Jachs M, et al. High histamine levels are associated with acute-on-chronic liver failure and liver-related death in patients with advanced chronic liver disease. Liver Int. 2024 Aug 13.doi: 10.1111/liv.16056. IF = 6.0
简述:目前人们对组胺在晚期慢性肝病(advanced chronic liver disease,ACLD)中的作用知之甚少。本研究旨在研究ACLD各个阶段血浆组胺水平以及对预后[是否进展为慢加急性肝衰竭(ACLF)或死亡]的价值。本研究为一项单中心前瞻性肝硬化相关的队列研究,ACLD定义为达到门静脉高压(肝静脉压力梯度HVPG≥6 mmHg)和/或肝脏瞬时弹性成像测量肝脏硬度≥10 kPa的患者。复合终点定为ACLF和/或肝脏相关死亡。
研究纳入了2017年至2020年诊断为ACLD的251名患者。基线时82.5%患者存在显著的门静脉高压,HVPG中位数为17 mmHg(IQR 12-21),135名患者(53.8%)为失代偿期。血浆组胺中位数为8.5 nmol/L(IQR: 6.4–11.5),37.1%的患者组胺水平升高(>9.9 nmol/L)。组胺水平在不同CTP分级(A,B,C)、MELD分层(<10,10-14,≥15)、HVPG分层(0-9,10-19,≥20)中没有显著差异。组胺水平与循环功能障碍的标志物(如钠、肾素、醛固酮)相关。在中位随访29.2个月期间,68名患者发展为ACLF或肝脏相关死亡。在单因素和多因素分析中(调整年龄、性别、HVPG以及MELD、临床分期和血清白蛋白或者CTP和血清钠),组胺水平升高仍然与复合终点相关。基于CTP的多元模型调整后亚分布风险比(asHR)为1.010(95%CI:1.004-1.021),P<0.001;基于MELD的多元模型asHR为1.030(95%CI:1.017-1.040),P<0.001。
简评:本研究发现高组胺水平与ACLD患者的循环功能障碍之间存在相关性,并发现ACLD患者高组胺水平与其发生ACLF风险或肝脏相关死亡风险独立相关。即便根据疾病严重程度调整后结果也是如此。该研究仍具有一些局限性。例如研究设计为观察性/横断面设计,未对血浆组胺水平升高的机制以及组胺在ACLD中的生物效应的深入了解。且研究缺少验证队列。另外,该研究未排除服用H1或H2阻滞剂的患者,可能影响血浆组胺水平。未来可进行前瞻性、验证队列研究,探索血浆组胺与循环功能障碍和ACLF之间的关联机制,探究针对组胺信号对ACLD患者的潜在治疗作用。
参考文献:
[1] Li H, Xia Q, Zeng B, et al. Submassive hepatic necrosis distinguishes HBV-associated acute on chronic liver failure from cirrhotic patients with acute decompensation. J Hepatol. 2015 Jul;63(1):50-9. doi: 10.1016/j.jhep.2015.01.029.
[2] Hu C, Jiang N, Zheng J, et al. Liver volume based prediction model for patients with hepatitis B virus-related acute-on-chronic liver failure. J Hepatobiliary Pancreat Sci. 2022 Dec;29(12):1253-1263. doi: 10.1002/jhbp.1112.
