
编者按:在广阔的医学研究领域中,免疫治疗以其独特的机制和潜力,正逐渐成为肿瘤治疗的新前沿。特别在妇科肿瘤领域,免疫治疗的探索更是充满挑战与希望。在2024长三角妇科肿瘤青年医师学术研讨会上,复旦大学附属妇产科医院的姜伟教授为我们带来了卵巢癌免疫治疗的探索,【医悦汇】特此整理,以飨读者。
专家介绍

姜伟
复旦大学附属妇产科医院妇科肿瘤科副主任
复旦大学附属妇产科医院卵巢癌学组组长
哈佛医学院访问学者
复旦大学卵巢癌研究所(FIOC)副所长
中华医学会妇科肿瘤学分会青年学组委员
上海市医学会妇产科专科分会青年委员
免疫治疗在卵巢癌领域的进展
在卵巢癌免疫治疗的研究领域,尽管近年来取得了一些进展,但与宫颈癌和子宫内膜癌相比其发展步伐仍然稍显缓慢。免疫治疗的核心机制涉及肿瘤细胞释放抗原,这些抗原被抗原递呈细胞捕获并激活T淋巴细胞,激活后的T淋巴细胞通过血液或淋巴系统回流至肿瘤所在区域,进而发挥其杀伤肿瘤细胞的作用。基于这一机制,临床研究已经开发出多种药物和治疗策略,包括疫苗、免疫检查点抑制剂(例如针对CTLA-4、CD137、PD-1的抗体)及靶向治疗等。

免疫治疗自2010年代初在肿瘤学领域取得了迅猛进展。2014年帕博利珠单抗(Pembrolizumab)和纳武利尤单抗(Nivolumab)的推出标志着一个新时代的开始。随后,2017年PD-L1抑制剂阿维鲁单抗(Avelumab)和度伐利尤单抗(Durvalumab)的上市进一步推动了这一领域的发展。2018年,帕博利珠单抗在宫颈癌治疗领域的关键研究(KEYNOTE-158)及其后续研究(如KEYNOTE-826等)为宫颈癌和子宫内膜癌的治疗开辟了新的道路。然而,卵巢癌的免疫治疗领域尚未出现经过验证的高效药物,NCCN指南中也未对卵巢癌提供专门的治疗推荐,其治疗策略主要基于泛瘤种的研究结果。帕博利珠单抗和多塔利单抗(Dostarlimab)均因泛瘤种适应症被推荐在特定条件下用于PSR/PRR卵巢癌的治疗。多塔利单抗主要用于dMMR/MSI-H复发或晚期肿瘤,而帕博利珠单抗则更常用于MSI-H或dMMR实体瘤,以及TMB(肿瘤突变负荷)≥10Mb的高TMB肿瘤。

ICI在卵巢癌治疗的探索
ICI在复发卵巢癌治疗的探索
在卵巢癌的免疫治疗领域,目前的临床研究并未严格分组,主要聚焦于复发性卵巢癌患者,尤其是对铂类药物敏感的复发患者。研究主要集中在Ⅱ期和Ⅲ期。

在最近的研究中,一个引人注目的发现是帕博利珠单抗与伦伐替尼的联合应用。这种联合疗法在针对铂敏感复发(PSR)卵巢癌患者的完全去化疗研究中显示出了令人鼓舞的客观缓解率(ORR)。然而,尽管在联合贝伐单抗、靶向治疗或化疗的情况下,所有研究均显示出ORR的显著提升,但最终的总生存期(OS)和无进展生存期(PFS)的改善并不明显。这些结果显示,可能只有少数卵巢癌复发患者能够从免疫治疗中获益。因此,我们面临的挑战是如何识别那些可能从免疫治疗中受益的患者群体,以便更精准地定位和治疗这部分患者。
ICI在晚期卵巢癌一线维持治疗中的探索

在一线维持治疗的研究领域,我们也观察到了许多积极的进展。其中包括单药维持治疗,这种治疗方法显示出了较高的客观缓解率(ORR)。此外,还有研究探讨了单药治疗与化疗的联合维持策略。特别值得一提的是阿维鲁单抗的Ⅲ期临床研究,研究结果显示尽管ORR有所提高,但患者的无进展生存期(PFS)和总生存期(OS)并没有显著的额外获益。
DUO-O研究也是一项备受关注的Ⅲ期临床试验,尽管包含了多种治疗组合,但结果显示免疫检查点抑制剂联合贝伐单抗的效果并不优于贝伐珠单抗单药治疗,且与PAOLA-1研究相比,联合治疗也未展现出显著优势,这可能与研究设计中的局限性有关。此外,在双特异性抗体领域的研究中,虽然有一项Ⅱ期临床试验正在进行,但遗憾的是,目前的结果并未显示出显著的总生存期(OS)改善。
如何识别卵巢癌免疫治疗获益的人群
在深入研究如何识别那些可能从卵巢癌研究中获益的患者群体时,我们面临着双重挑战:对于患者来说,寻找有效的治疗方案是至关重要的;而对于临床医生来说,准确识别这些患者同样是一项艰巨的任务。因此,关键在于如何精确地识别出那些可能从免疫治疗中获益的特定患者群体。

我们的研究可能会从以下几个方面进行考量:首先是肿瘤的内源性因素,正如我们在宫颈癌案例中所讨论的,我们需要检测PD-L1的表达水平、微卫星不稳定性、POLE/POLD基因突变等指标。其次,肿瘤的外源性因素也不容忽视,这包括微生物组、细胞因子以及肿瘤微环境等。此外,肿瘤浸润性淋巴细胞(TLS)、肿瘤细胞的组学分析,例如T细胞受体(TCR)的分析,也是我们研究的重点。在其他类型的癌症中,PD-L1的表达、错配修复缺陷/微卫星不稳定性高(dMMR/MSI-H)、肿瘤突变负荷高(TMB-H)等指标已被广泛认可,被用于预测免疫治疗效果,筛选免疫治疗有效人群。

但在卵巢癌的治疗中,我们观察到的现象与其它类型肿瘤有所不同。尽管卵巢癌患者的PD-L1阳性率相对较高,有时甚至可以达到60%,但这种高表达并没有直接转化为患者对免疫单药治疗或联合化疗的显著反应。具体来说,虽然客观反应率(ORR)有所提高,但患者并未因此获得预期的显著临床益处。与宫颈癌和内膜癌相比,卵巢癌患者的PD-L1高表达并不总是预示着良好的治疗反应。此外,卵巢癌患者dMMR、MSI-H和TMB-H患者比例相对较低,需要进一步的研究来探索它们在卵巢癌治疗中的作用。

PD-L1表达再分析
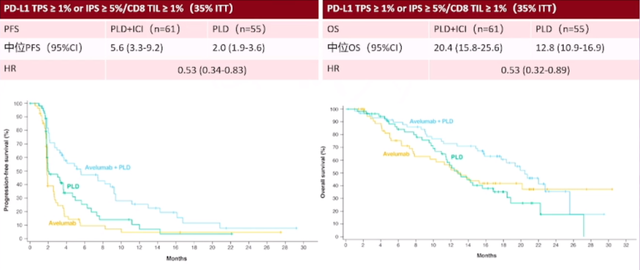
我们还可以观察到PD-L1的再表达现象,卵巢癌存在多种亚型,这些亚型在PD-L1的表达上存在差异。随着治疗进程的推进,比如患者接受了新辅助化疗、手术或其他靶向治疗,PD-L1的表达水平可能会发生一系列变化,这些变化可能会对治疗效果产生影响。临床研究已经注意到了这一点,并据此进行了患者分层研究。观察结果显示,在PD-L1肿瘤比例评分(TPS)大于1%且免疫细胞比例评分(IPS)大于5%的患者中,使用TC方案联合贝伐单抗与TC方案联合贝伐单抗加免疫检查点抑制剂(的治疗方案,可以显著区分治疗效果。这意味着,对这部分患者进行亚组分析,可能会为我们提供更准确的治疗预期,从而为患者制定更为个性化的治疗方案。

其它生物学标志(PD-L1/CD8 TIL)
同样地,对于CD8阳性T淋巴细胞与PD-L1表达的联合研究也取得了一些进展。研究发现,当CD8阳性T淋巴细胞与PD-L1表达呈现双阳性时,这部分患者能够被有效区分。这一发现在卵巢癌的研究领域中尤为突出,是目前报道中较为积极的结果之一。
其他生物学标志(T cell-Gene expression profile, GEP)
关于肿瘤微环境的组学分析,尽管其在临床直接应用上存在一定的局限性,但它在精准医学领域却发挥着不可或缺的作用。特别是通过单细胞测序技术,我们能够揭示T细胞的组学特征,以及细胞因子的表达模式,这些发现与免疫治疗的效果紧密相关。
三级淋巴结构(TLS)
我们的课题组正在进行的研究正是关于三级淋巴结构(TLS)的,最新发现表明,在卵巢癌患者中,三级淋巴结构表达阳性的病人其预后有所提高。这一发现与在其他类型肿瘤中的研究结果相呼应,包括黑色素瘤、肺癌、结直肠癌等,这些肿瘤中TLS表达较高的患者对免疫检查点抑制剂的反应也更为良好。
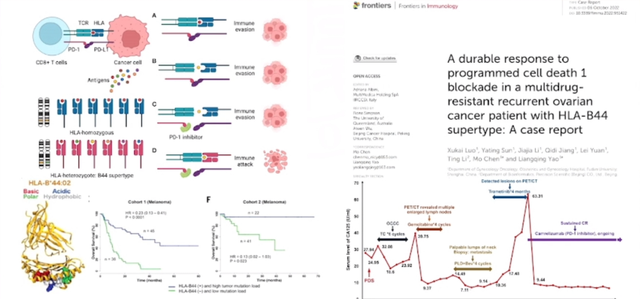
其他生物标志物(HLA-1)
在我们的研究中同样关注了类似于人类白细胞抗原(HLA)这样的分子。研究显示,这些分子在某些卵巢癌患者中扮演着重要角色。特别值得一提的是HLA-B44亚型,它在预后方面表现出色,HLA-B44阳性的复发性卵巢癌患者对免疫治疗的反应也非常好。
免疫治疗在少见类型卵巢恶性肿瘤中的应用

在特殊类型的卵巢癌,尤其是透明细胞癌(OCCC)的治疗中,免疫治疗已成为一个重要的研究方向。透明细胞癌在亚洲患者中的占比相对较高,且对传统含铂化疗的反应较差,因此探索新的治疗策略显得尤为迫切。
ARIDIA基因的突变在透明细胞癌中较为常见,且与微卫星不稳定性(MSI)和肿瘤突变负荷(TMB)密切相关。这些生物标志物在预测免疫治疗反应中可能起到关键作用。例如,ARIDIA基因突变可能影响肿瘤的免疫原性,从而影响免疫治疗的效果。
在2024年美国妇科肿瘤学会(SGO)年会上,高庆蕾教授报告了INOVA研究的结果,该研究探讨了信迪利单抗联合贝伐珠单抗用于治疗复发或持续性卵巢透明细胞癌的疗效。研究显示,这种联合方案的客观缓解率(ORR)达到了40.5%,其中完全缓解(CR)率达到了13.5%,中位持续缓解时间(mDoR)为22.2个月,中位无进展生存期(mPFS)为6.9个月,这些结果表明信迪利单抗联合贝伐珠单抗的方案在治疗复发或持续性卵巢透明细胞癌方面具有显著的疗效和可控的安全性。
此外,马丁院士在ASCO的报道中也提到了免疫治疗在妇科肿瘤中的探索,包括宫颈癌和子宫内膜癌。这些研究结果为透明细胞癌的免疫治疗提供了新的视角,并可能为其他类型的妇科恶性肿瘤提供治疗新思路。
本文由医悦汇编辑整理版权声明
本文版权归医悦汇所有。欢迎转发分享,其他任何媒体如需转载或引用本网版权所有内容,须获得授权,且在醒目位置处注明“转自:医悦汇”。

