AbMole精研抑制剂十年,最新的科研动态不断与您分享。本期与您分享的是:oxLDL/β2GPI/抗-β2GPI复合物通过PI3K/AKT/mTOR和eNOS信号通路诱导的自噬受损有助于内皮细胞功能障碍。
内皮细胞功能障碍在动脉粥样硬化(AS)的发病机制中起基础性作用,而内皮细胞自噬在AS的发生发展中具有保护作用。我们前期研究表明氧化低密度脂蛋白/β2糖蛋白I/抗-β2糖蛋白I抗体(oxLDL/β2GPI/抗-β2GPI)复合物可促进炎症细胞因子的表达,增强白细胞与内皮细胞的粘附。在目前的研究中,我们旨在评估oxLDL/β2GPI/抗-β2GPI复合物对内皮细胞自噬的影响,并探索相关的潜在机制。以人脐静脉内皮细胞(HUVECs)和小鼠脑内皮细胞系(bEnd.3)为血管内皮细胞模型。通过western blotting分析检测自噬蛋白的表达来评估自噬,通过透射电镜检测自噬体的积累,通过溶酶体抑制剂氯喹检测RFP-GFP-LC3腺病毒转染和自噬通量。western blotting法检测细胞中磷酸化PI3K、磷酸化Akt、磷酸化mTOR和磷酸化eNOS的表达。用3-甲基腺嘌呤(3-MA)和雷帕霉素Rapamycin检测自噬在oxLDL/β2GPI/抗β2GPI复合物诱导的内皮细胞功能障碍中的作用。我们发现,oxLDL/β2GPI/抗-β2GPI复合物抑制自噬,其表现为p62蛋白增加,LC3-II和Beclin1减少,内皮细胞自噬体生成减少。此外,自噬抑制与PI3K/AKT/mTOR和eNOS信号通路有关。雷帕霉素抑制了oxLDL/β2GPI/抗β2GPI复合物诱导的内皮细胞炎症、氧化应激和凋亡,而3-MA单独诱导内皮细胞损伤。我们的研究结果表明,oxLDL/β2GPI/抗-β2GPI复合物通过PI3K/AKT/mTOR和eNOS信号通路抑制内皮细胞自噬,进而导致内皮细胞功能障碍。总之,我们的研究结果为具有抗磷脂综合征(APS)背景的AS患者的血管内皮损伤提供了一种新的机制。

AZD5363(Abmole,M2303,纯度>99%)有效抑制Akt(Akt1/Akt2/3)的所有亚型,IC50为3 nM/8 nM/8 nM,对P70S6K/PKA也具有相似的抑制效果,对ROCK1/2具有较低的抑制活性。Rapamycin(Abmole,M1768,纯度>99%)是一种选择性的mTOR抑制剂,IC50为~0.1 nM。L-NAME hydrochloride(Abmole,M2818,纯度>99%)是一种无选择性的一氧化氮合成酶抑制剂,对nNOS (牛源),eNOS (人源)和iNOS (鼠源)的Ki值分别为15nM,39 nM和4.4μM。3-methyladenine (3-MA)(Abmole,M2296,纯度>98%)是一种选择性PI3K抑制剂,作用于Vps34和PI3Kγ,IC50分别为25μM和60μM;永久抑制I型PI3K,但对III型PI3K的抑制是短暂的,也抑制自噬体的形成。
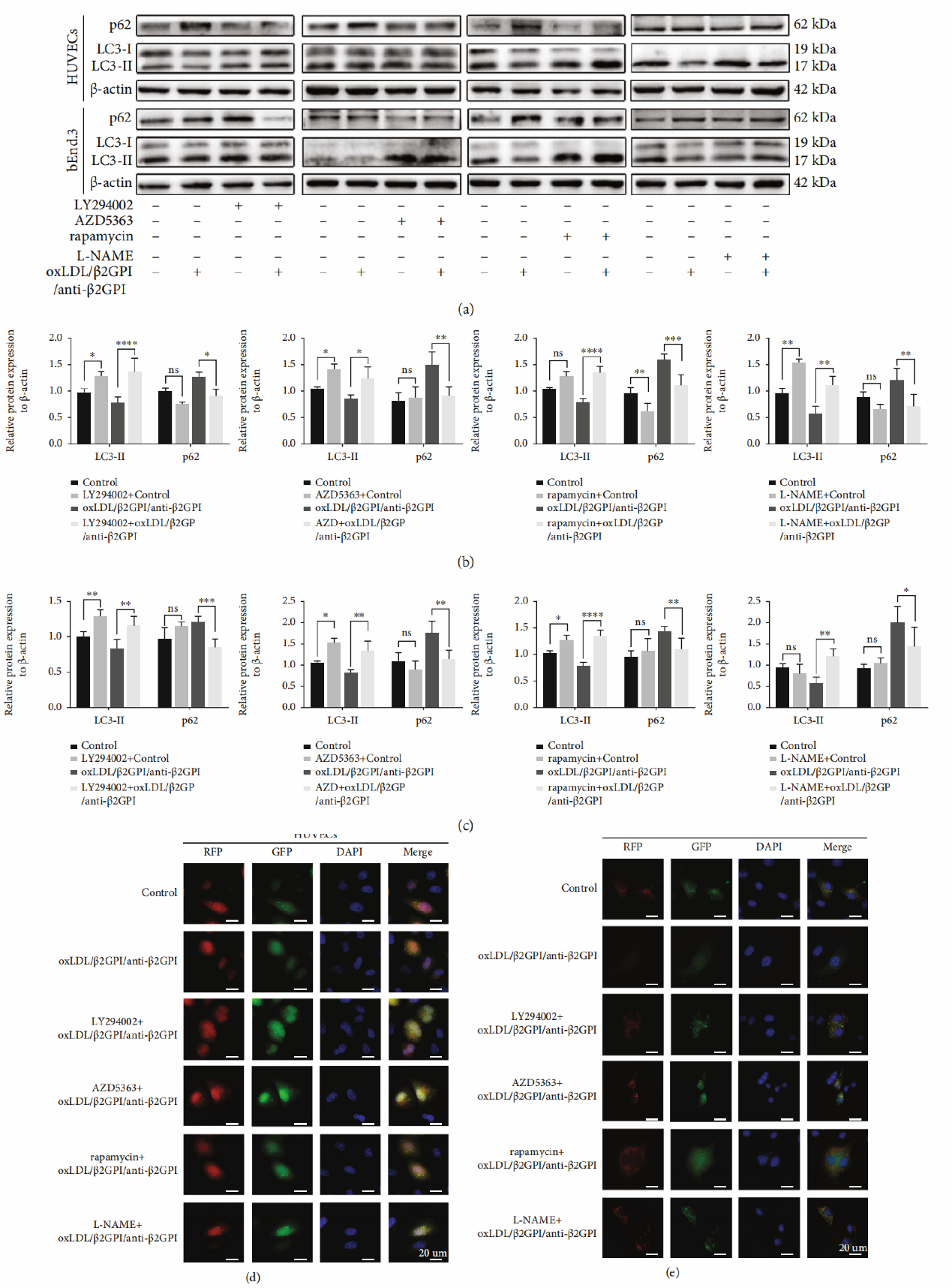
Figure 5: The regulation of PI3K/AKT/mTOR and eNOS signaling pathways in oxLDL/β2GPI/anti-β2GPI complex-mediated endothelial autophagy.
OxLDL/β2GPI/抗-β2GPI复合物诱导内皮细胞PI3K/AKT/mTOR自噬缺失和eNOS依赖性。我们研究了上述信号通路是否参与了oxLDL/β2GPI/抗-β2GPI复合体抑制内皮细胞自噬的作用。我们用PI3K (LY294002)、AKT (AZD5363)、mTOR (AZD5363)或eNOS (L-NAME)等特异性抑制剂预处理细胞,并检测了LY294002、AZD5363、雷帕霉素或L-NAME对自噬蛋白表达和LC3瘤聚集的影响。我们发现LY294002、AZD5363、雷帕霉素和L-NAME预处理与单独oxLDL/β2GPI/抗-β2GPI复合体组相比,可显著上调LC3-II的表达,而下调p62的表达(P < 0: 05;图5b和5c)。此外,在LY294002、AZD5363、雷帕霉素和L-NAME预处理后,oxLDL/β2GPI/抗-β2GPI复合体组LC3点的聚集明显增加(图5d和5e),表明抑制PI3K/AKT/mTOR和eNOS通路逆转了oxLDL/β2GPI/抗-β2GPI复合体对自噬的抑制作用。

Figure 6: Activation of autophagy decreases oxLDL/β2GPI/anti-β2GPI complex-induced expressions of endothelial inflflammatory cytokines.
内皮细胞自噬的激活降低了内皮细胞中oxLDL/β2GPI/抗β2GPI复合物诱导的炎症细胞因子的表达。我们前期研究表明,oxLDL/β2GPI/抗-β2GPI复合体通过促进多种炎症细胞因子的表达参与内皮细胞炎症反应。在本研究中,我们通过使用自噬激活剂雷帕霉素和自噬抑制剂3-MA进一步研究了oxLDL/β2GPI/抗β2GPI复合物诱导的自噬抑制是否与内皮炎症相关。与前人的研究结果一致,我们的研究结果显示,在HUVECs中,雷帕霉素(1μM)处理后LC3-II的表达和LC3点的聚集增加,而3-MA (5 mM)处理后LC3-II的表达减少。我们发现,与单独oxLDL/β2GPI/抗-β2GPI复合体组相比,雷帕霉素治疗在mRNA水平下调了IL-1β、IL-6和ICAM-1的表达(图6a-c)。同时,与单独oxLDL/β2GPI/抗-β2GPI复合体组相比,3-MA显著增加了这些炎症细胞因子的表达(图6a-c)。此外,IL-1β和IL-6的分泌以及ICAM-1的表达也遵循类似的趋势(图6d-f)。

Figure 7: Activation of autophagy reduces oxLDL/β2GPI/anti-β2GPI complex-induced endothelial oxidative stress.
内皮细胞自噬的激活可防止oxLDL/β2GPI/抗β2GPI复合物诱导的内皮细胞氧化应激。ROS积累引起的氧化应激与内皮功能障碍密切相关,导致AS的进展。因此,我们使用ROS检测染料DCFH-DA检测ROS的生成。荧光显微镜显示,在oxLDL/β2GPI/抗-β2GPI复合物暴露的细胞中,ROS的产生明显增加,而雷帕霉素的加入消除了oxLDL/β2GPI/抗-β2GPI复合物对ROS产生的诱导作用(图7a)。与对照组相比,自噬抑制剂3-MA处理的细胞中ROS的积累增加,但与单独oxLDL/β2GPI/抗-β2GPI复合物治疗组相比,无明显变化(图7a)。我们进一步通过流式细胞术证实了这些作用,发现雷帕霉素可以恢复oxLDL/β2GPI/抗-β2GPI复合物对ROS产生的促进作用(图7c-d)。同时,oxLDL/β2GPI/抗β2GPI复合体组和3-MA组细胞形态不规则,边界模糊,而雷帕霉素和oxLDL/β2GPI/抗-β2GPI复合体共处理后细胞形态完整,边界清晰(图7b)。此外,我们还检测了SOD的生成。与对照组相比,OxLDL/β2GPI/抗-β2GPI复合物显著降低了SOD活性,而添加雷帕霉素逆转了OxLDL/β2GPI/抗-β2GPI复合物对SOD活性的影响(图7e)。此外,与对照组相比,3-MA组SOD活性降低,与单独oxLDL/β2GPI/抗-β2GPI复合体组相比无显著差异(图7e)。

Figure 8: Activation of autophagy attenuates oxLDL/β2GPI/anti-β2GPI complex-induced endothelial apoptosis.
内皮细胞自噬的激活抑制oxLDL/β2GPI/抗β2GPI复合物诱导的内皮细胞凋亡。流式细胞术和western blotting分析显示,oxLDL/β2GPI/抗-β2GPI复合物诱导HUVECs凋亡(图8),这与之前的研究一致。同时,我们研究了自噬诱导对oxLDL/β2GPI/抗β2GPI复合体诱导的细胞凋亡的影响。我们发现,与单独oxLDL/β2GPI/抗-β2GPI复合物组相比,oxLDL/β2GPI/抗-β2GPI复合物和雷帕霉素联合治疗可显著抑制HUVECs的凋亡,而3-MA治疗组无明显变化(图8a-b)。western blotting分析进一步支持了这一发现,在oxLDL/β2GPI/抗-β2GPI复合物和雷帕霉素处理的细胞中,cleaved caspase-3和cleaved caspase-9在蛋白质水平上显著下调(图8c-e)。值得注意的是,与单独使用oxLDL/β2GPI/抗-β2GPI复合体处理的细胞相比,3-MA组中cleaved caspase-3和cleaved caspase-9在蛋白水平上的表达进一步升高(图8c-e),表明抑制自噬可加剧细胞凋亡。
鸣谢:Guiting Zhang, et al. Oxid Med Cell Longev. 2021 Jun 14;2021:6662225.
