仅供医学专业人士阅读参考
点击右上方“关注”,准时接收每日精彩内容推送。
神经障碍是全球残疾和死亡的主要原因之一,其特点是护理成本上升、人口老龄化和并发症增加。例如,据估计到2050年,阿尔兹海默症将导致每年1.6万亿美元的直接医疗成本。此外,在过去的三十年里,精神疾病和心理障碍变得更加普遍。因此,需要有效的神经或精神障碍治疗药物,其中对大脑结构的分子、细胞、组织和器官尺度的病理生理学和治疗的基本理解至关重要。因此,需要进一步研究以了解诸如痴呆症和精神分裂症等难以捉摸的疾病的根本原因。例如,阿尔茨海默病中的记忆丧失与神经连接的中断、血脑屏障(BBB)功能障碍和蛋白质聚集有关。然而,这些不同病理生理过程之间的关系和事件顺序仍然不清楚。因此,开发复杂神经系统疾病的有效靶向疗法很困难,因为机制途径没有得到很好的表征。当前,学者们已经开发出了体外脑模型,如脑芯片设备,以模拟体内的生化和机械生物学相互作用,并监测其电化学活动。
来自澳大利亚墨尔本大学的David R. Nisbet和David Collins团队讨论了构建复杂脑模型的技术。本文讨论了微流体技术和基于半导体的技术的进展,这些技术促进了体外模拟血脑屏障和神经元电路,以研究病理生理过程。本文还进一步讨论了3D组织工程、电极策略和材料的进步,当这些结合起来时,可以允许模拟大脑区域的原生复杂性,并在细胞长度尺度上询问它们的活动。此外,本文探索了复杂的生理相关脑芯片设备的工程挑战和机遇及其未来的进展。相关工作以题为“Engineering brain-on-a-chip platforms”的综述文章发表在2024年06月05日的顶级期刊《Nature reviews bioengineering》。

本文亮点:
(1)脑芯片设备允许培养和监测血脑屏障和大脑实质的高度复杂模型。
(2)一系列广泛的体外脑建模方法(如生物打印和微流体学)已经商业化。
(3)需要根据具体的研究问题来定制脑模型的复杂性。
(4)由于许多技术是独立开发的,确保工作流程相互兼容以解锁脑芯片设备的全部潜力仍然是一个挑战。
器官芯片(Organ-on-a-chip)系统可利用微制造和/或生物制造原理来模仿组织层面的生理或病理生理反应,是模拟人类生理学和细胞微环境的新兴途径,包括血脑屏障和大脑实质。最初,血脑屏障芯片和脑芯片设备是作为独立实体开发的。然而,对于许多神经、生理和疾病过程,这些结构不能被独立研究。因此,本综述中的脑芯片设备被定义为一种微制造和/或生物制造的设备,通过模拟生理相关环境来模拟大脑血管系统、血脑屏障和/或大脑实质组织,并具有感知和/或驱动这些组织的能力。当前,微电极被用来开发研究大脑生理学的工具。例如,具有密集传感能力和小电极尺寸的透明柔性电极阵列是重要的体内大脑接口工具。由于基于电极的记录和刺激系统向多模式、灵活和透明的电极阵列发展的趋势在体内和体外都相似,它们在制造、接口和数据收集方面面临许多相似的挑战。例如,体内的刚性探针进展为更灵活和透明的电极阵列。同样的转变也出现在体外多电极系统中。整合高保真(电)刺激和记录方法以询问组织功能对于评估和刺激大脑组织功能很重要。然而,与体外方法相比,后者可以在长时间内以细胞尺度询问组织,体内的方法是迄今为止有限的能力来评估组织完整性和监测详细的神经网络(功能障碍)在阿尔茨海默病和其他神经退行性疾病中的功能。
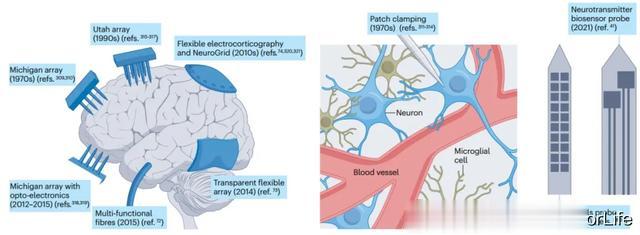
图1 在脑生理学中探测不同尺度下神经活动的方法
商业微电极制造中使用的制造技术,包括硅蚀刻和电极沉积,可以用来耦合生物和电子系统。然而,这些最初为不透明、生物不相容且坚硬的计算机电子设备开发的技术的材料和二维特性范围有限,这在神经学研究中提出了挑战。只有采用最小化炎症的设计和涂层,才能实现从穿透皮层的电极进行长期记录。体外电生理传感工具已经经历了一系列发展来解决这些问题。
本综述讨论了开发脑芯片模型的主要标准和方法,强调了关键发展和未来展望。首先,这些模型应该具有生理相关性、可重复性和用户友好性。其次,它们理想情况下应包括以下元素:内皮细胞、周细胞、星形胶质细胞和神经元的层次空间模式和互连性,以及在适当的剪切应力下动态供应的营养物质和生长因子;允许发育中的组织扩散和重塑的生物相容材料,具有可控的微机械线索和渗透压;实时时空电生理测量;连续的BBB和组织完整性测量,以及使用生物传感器和成像实时监测组织或细胞结构和功能——给定模型中这些元素的特定组合是其解决给定研究问题能力的函数。最后,讨论了如何开发和优化脑芯片模型可以促进临床意义、成本效益和快速筛查疾病相关标志物和药物,以及对BBB微环境的长期监测。
【微流体模型】
脑芯片(Brain-on-a-chip)设备主要基于神经元细胞培养,有学者试图在这些模型中整合血脑屏障(BBB)的结构和功能。BBB模型旨在解决的主要挑战是生成在脑组织中发现的结构和细胞排列,其中内皮细胞、周细胞、星形胶质细胞和神经元以神经血管单元的形式独特排列,每个都具有独特的功能。确立内皮细胞间足够紧密连接形成和生理相关细胞迁移与形态的关键参数是应用物理线索,例如来自层流连续流动的剪切应力。几种方法已经出现以生成BBB结构,包括多孔膜分离的堆叠通道、带有限制或图案化脉管系统的平行通道以及带有自组装脉管系统的平行通道,试图在模型的生理相关性复杂性和对细胞层和类型的特定位置与排列的控制之间取得平衡。由于微流控设备允许日益复杂的血管模型,它们还整合了比以前仅内皮细胞模型更高的细胞类型多样性以及动态流体流动相互作用和更复杂的(生物)材料的集成。然而,更复杂的脉管系统增加了持续监测组织完整性的挑战。
为了生成代表性的细胞结构,水凝胶和其他生物材料可以通过促进自组装和结构重塑以及提供机械支持和扩散传输来帮助形成2.5D和3D配置。例如,通过将水凝胶层与微流控技术结合,MIMETAS公司已经商业化了设备,其中小塑料脊作为不同细胞种群的相位导向。这些设备中的水凝胶-液体2.5D界面可以用内皮细胞播种,以创建独立的屏障,如血-视网膜屏障,甚至是内皮细胞、神经元、小胶质细胞和星形胶质细胞的完整四重共培养。此外,这些设备允许可扩展性和自动化,例如,用于将神经上皮干细胞分化为多巴胺能神经元以构建特定于患者的帕金森模型。
然而,许多微生理系统仍然高度复杂且成本有限,这是由于不同来源的细胞类型的组合。在这方面,可以采用几种策略,如仔细选择细胞的来源和使用各种分化方案(图2b),以改善生理相关性并降低模型复杂性。例如,建立BBB或大脑模型可以使用原代内皮细胞。原代人脑微血管内皮细胞(BMECs)的培养也是可能的,但需要获取人脑组织,且只能有限次数传代。星形胶质细胞和周细胞培养的作用类似。因此,缺乏长期表型稳定的细胞来源增加了使用这些细胞的模型的成本和劳动需求。而细胞系提供了易于处理和更便宜的替代品,但它们并不完全模仿生理屏障特性或细胞外基质(ECM)的产生。
因此,目前已经建立了诱导多能干细胞(iPS)模型,包括在微流控BBB模型中。此外,可以使用这些培养物检查疾病和非疾病状态下遗传突变的影响,这些培养物可以调整到所需的发育阶段。然而,分化协议仍然复杂、昂贵且对小环境变化敏感。此外,需要进行验证以确保每种细胞类型的身份,常见的人类BMECs分化协议可能导致细胞表达上皮细胞样特性而非生理相关的内皮细胞命运。使用iPS细胞衍生的BBB模型进行的研究,如亨廷顿病、22q11.2缺失综合征、精神分裂症和SARS-CoV-2感染相应地包括对分化协议结果的进一步分析和对最终细胞状态严格表征的需求的评论。在设备内生成特定于患者的细胞类型有几种策略,包括从胚胎干细胞分化或直接使用体细胞。高度异质且生理相关的血管网络也可以通过内皮细胞在水凝胶中的自组装来创建。然而,自组装过程仍然高度可变。尽管有时这些网络可能是可灌注的,但这些内部的生理剪切应力不容易控制或评估。此外,附着在不同大小和极性的无毒聚合物上的荧光标记物,如异硫氰酸荧光素葡聚糖,可能在体外通过微流控壁和水凝胶空间中的细胞层之间的间隙泄漏,这复杂化了网络通透性的分析。尽管如此,最先进的方法理想地能够在3D患者特异性自组装血管网络中实现多重细胞类型的共培养。兼容自组装网络的微流控芯片已由AIM Biotech等公司商业化(organiX, idenTx芯片)。

图2 BBB 和神经元体外模型
【电生理读数】
对于许多组织类型,通过光学和遗传分析可以研究体外培养的细胞和分子特征。然而,要充分理解神经元和神经网络的功能,必须记录单个神经元及其细胞间或网络通讯的电活动。单神经元记录的金标准是膜片钳技术,它可以在亚细胞甚至单个离子通道水平上评估膜运输。来自单个神经元的高时间分辨率(亚毫秒级)和高信噪比的详细信息允许深入调查通道多态性或药物相互作用。然而,膜片钳通常限于一次记录少量神经元,不适合评估神经网络规模上的活动。基于微流控捕获单个细胞于微尺度孔径中的机柜大小膜片钳仪器,如Nanion Syncropatch 384TM和Sophion Qube 384TM,通过自动化移液允许同时记录多达384个孤立细胞在高度限制的环境中的活动。然而,网络中评估的神经元数量仍然有限,需要物理接入插入探针,且很难将膜片钳与长期细胞培养整合。一种常用的方法是同时记录大型神经网络中神经元的电活动,即钙成像。该技术涉及用荧光染料标记细胞,这些染料由Ca2+的存在激活,或使用遗传编码的Ca2+指示剂,并通过光学观察细胞活动。然而,Ca2+信号与电活动只有间接相关,Ca2+流入作为神经激活的代理。因此,这种方法相应地受到限制,因为与电信号相比,荧光信号通常发生得较慢。在过去的十年中,荧光遗传编码Ca2+指示剂已达到~100毫秒的上升时间,相比之下,神经元中的动作电位为1毫秒。然而,最近的工作已实现了5毫秒的半上升时间和200毫秒的半衰减时间,使其非常适合于信号在数百毫秒到几秒内演变的各种细胞类型(例如,星形胶质细胞)。此外,空间分辨率由光穿透决定,近红外光可高达毫米长度尺度(通常比大多数电极具有更高的空间分辨率,其中典型的光学显微镜受限于大约数百纳米,而许多电极为~10微米),尽管仍然难以构建深层组织的3D神经元活动图。在这里,基于Ca2+信号的高时空分辨率神经元记录,在微秒和毫秒尺度上,通过显微镜平台和遗传编码的传感器实现。
【3D 组织构建】
大多数电生理记录系统在体外对稀疏的2D培养或小型组织构建进行操作。完整的生物体具有与2D细胞培养固有不同的细胞-细胞和细胞-基质相互作用,即使是混合细胞系统也是如此。然而,根据研究问题,3D培养可能并非总是必需的,因为它们比2D培养更难以标准化和复制,包括那些在微流控设备和/或基于水凝胶的细胞培养中的培养。此外,与3D培养相比,2D培养更便宜、组装更省时、可重复性更高,且依赖于更标准的实验和成像方法,许多商业测定和成像设置也针对2D培养进行了优化。此外,3D培养需要长时间的培养、复杂的灌注系统和复杂的数据分析。然而,3D培养方法可以更好地控制物理线索(例如,硬度)、细胞-ECM相互作用或以生理代表性方式的细胞信号梯度。例如,某些神经元的自发放电或不同组织区域之间的交叉迁移可能只在复杂的3D细胞排列中表达。这样的细胞培养可以通过创建可靠、易用和可定制的微环境来辅助,包括那些基于水凝胶的环境。
【材料多样化】
虽然可以选择支架来优化ECM或生物打印特性,但当考虑电生理读数或集成生物传感器时,会出现额外的挑战。传统上,电子产品由固体材料(例如金属和半导体)制成,表现出高机械刚性(杨氏模量约100 GPa),而脑组织通常具有<1 kPa的弹性模量。然而,已经开发了基于电极的方法,这些电极因组织产生的力而变形,因此对组织发展的影响最小。此外,CMOS系统,如HD-MEAs,需要广泛的钝化层,如SiO2和Si3N4,以保护下面的电路,以及生物兼容的环氧树脂来将焊线与培养基分开。然后,这些表面涂有蛋白质,如层粘连蛋白,以增加细胞粘附和表面亲水性。除了影响细胞行为发展外,如果不使用柔性材料和涂层,固体材料和细胞之间的内在机械和化学不匹配可能会影响电极耦合和长期信号记录质量。通过结合聚合物基质、导电填料材料和导电水凝胶,可以产生类似组织的机械性能和电导率。已经使用了各种导电材料,包括导电聚合物(例如,PEDOT:PSS、聚苯胺和聚吡咯)、碳基纳米材料和金属基纳米材料。对于导电水凝胶,重要的是在不损害水凝胶的物理化学性质的情况下实现高电导率;光交联和合成水凝胶可以生成图案化的、表面附着的和电化学稳定的导电水凝胶涂层。例如,PEDOT:PSS已与GelMA复合,其中GelMA-PEDOT:PSS混合水凝胶被生物打印以形成具有基于PEDOT:PSS浓度可调电导率的3D结构,并在肌母细胞系中保持了良好的生物相容性(>95%存活率)。
【生物传感器集成化和多样化】
多种生物传感模式可用于检测不同的分子和离子目标。在传感器中,基于适体的神经递质传感进展使得可插入探针的开发成为可能,用于体内研究。然而,由于适体-目标相互作用的复杂性和对环境因素的依赖,为生物传感选择合适的适体序列仍然具有挑战性。总的来说,大多数生物传感技术的标准、兼容性和可扩展制造方法的实施还需要进一步的研究。此外,还需要研究将生物传感器多重整合到神经元和血脑屏障模型中。
【技术路线】
为了开发复杂的脑芯片模型,应当关注扩大组织培养的范围、优化微流控技术、改进生物传感以及电刺激和测量模式及其整合(图3)。模型所需的复杂程度最终由提出的研究问题驱动,每个具体询问相关的不同组件和方法的整合。在这种情况下的挑战是,跨不同领域的系统实施需要标准化和/或协作,尽管许多这些领域仍然独立地而不是协同地发展。额外的挑战包括用于开发模型的各种组装、材料和方法的广泛多样性。生物来源材料的有限标准化,如细胞和一些水凝胶,进一步构成了实现可重复性的障碍。解释这些系统结果的另一个障碍是使用类似方法的广泛实验设置范围,使得直接比较获得的结果更加困难。随着这些系统及其组件的商业可用性增加,预计将减轻这一挑战并提高细胞培养模型类型、微流控几何形状、电极和数据处理之间的标准化。

图3 通往日益集成的脑芯片设备组件和组装的技术路线图
总结与展望
脑芯片平台有希望用于研究生理和病理生理相互作用及途径,在这些平台上,可以连续质询组织,直至单细胞尺度。该方法在实时组织监测和控制、效能和成本方面与动物模型相比具有优势。然而,由于大脑的复杂性以及亚领域中不同的成熟阶段,目前建立一个通用模型仍然遥不可及。
了解更多
关注“EngineeringForLife”,了解更多前沿科研资讯
