γδT细胞作为一种非传统的T细胞亚群,近年来在免疫治疗领域得到了广泛的应用。它们具有非凡的抗肿瘤潜力和临床应用前景。近年来,许多研究表明,细胞毒性γδT细胞对自体、异体或异种肿瘤细胞具有较强的杀伤能力,其浓度往往与患者的临床预后密切相关。
与αβT细胞相比,γδT细胞可以不受主要组织相容性复合体(MHC)分子的限制而识别抗原,并以多种方式介导靶细胞的杀伤,参与免疫调节,具有更广泛的肿瘤细胞杀伤谱。γδT细胞作为先天免疫和适应性免疫之间的“桥梁”,是抵抗肿瘤的第一道防线,在肿瘤的发生发展中起着重要作用,可用于评价患者的预后。因此,基于γδT细胞的免疫治疗已在多种肿瘤中得到研究。
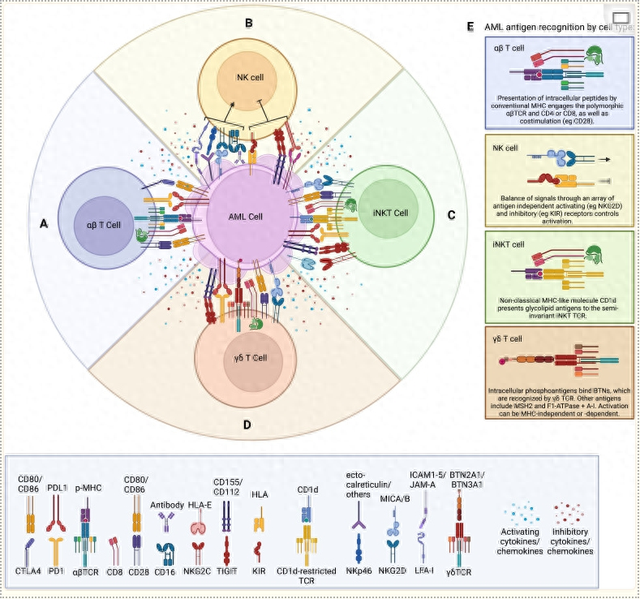
图1(5):常规αβTCR激活受体(包括αβTCR复合物、CD8、CD28)及抑制受体(如CTLA4、PD-1)示意图。
肿瘤微环境中产生的可溶性因子(如IL-6、IL-10、TGFβ和VEGF)被认为可以抑制细胞毒性T细胞反应。T细胞产生的可溶性因子依赖于亚型(如颗粒酶B和穿孔素由CD8;IFNγ通过Th1;IL-4, IL-5和IL-10被Th2;IL-10和TGFβ (Treg)。(B)通过非抗原依赖性激活和抑制受体的平衡调节NK的示意图。肿瘤产生的可溶性抑制因子包括IL-6、IL-10、TGFβ和VEGF。NK细胞产生的典型可溶性因子包括IFNγ、穿孔素、颗粒酶B和TNFα(C)通过MHC呈递的非多态性iNKT TCR结合糖脂以及NK细胞共有的非抗原依赖性激活和抑制受体激活iNKT细胞的示意图。iNKT细胞产生的可溶性因子包括细胞毒性分子[穿孔素,颗粒酶(B)],以及依赖于亚群的细胞因子(D) γδT细胞示意图,描绘了独特的γδTCR,它可以以hla依赖和hla独立的方式识别抗原。γδT细胞在细胞群中表达经典的T细胞标志物CD28和CD8。γδT细胞在衰竭过程中,抑制受体PD-1和TIGIT表达上调。γδT细胞也可以表达细胞毒性相关的NK细胞受体,如NKG2D,并产生一系列分泌因子,包括穿孔素、颗粒酶B、IFNγ和TNFα(E)如所示,每种细胞类型上存在的独特抗原识别机制的细节。
vγ9vδ2T细胞免疫治疗在实际应用中的安全性已得到部分证实,但只有10%~33%的血液学和实体恶性肿瘤患者从该治疗中获益(1)。γδT细胞是先天免疫系统的关键角色,通过表达细胞表面受体,如γδT细胞受体和自然杀伤群2D (NKG2D),直接诱导细胞毒性;γδT激活后,细胞释放细胞毒性细胞因子和趋化因子,直接促进肿瘤细胞的细胞溶解,此外,γδT细胞在适应性免疫系统中充当调节剂,可以通过启动αβT细胞、募集B细胞协助抗体产生和激活树突状细胞间接靶向肿瘤细胞。
γδT细胞通过表达死亡受体配体(FasL、TRAIL),产生细胞毒性分子(颗粒酶B、穿孔素、CD107a、IFN-γ、TNF-α),并通过表达CD16介导ADCC直接杀伤肿瘤细胞;γδT-抗原呈递细胞可以通过MHC-I、MHCII和共刺激分子激活常规T细胞,γδT细胞还通过分泌IFN-γ和TNF-α诱导DC成熟,并通过CD137L激活NK细胞(图2)。在临床前研究中,多种细胞毒性机制已被证明有助于γδT细胞抗肿瘤活性,并且在早期临床试验中观察到患者对γδT细胞免疫疗法的中度反应。

图2:细胞因子和受体-配体相互作用介导的γδT细胞抗肿瘤和促肿瘤功能
目前正在研究的γδT细胞有两个主要亚群:Vδ1和Vδ2。Vδ1T细胞虽然在肠、结肠和真皮等组织中富集,但只占循环外周血γδT细胞的一小部分。虽然研究表明,Vδ1T细胞可能对某些造血恶性肿瘤和实体瘤具有增加的细胞毒性潜能,但在制定符合GMP的扩增方案方面仍然存在挑战。与Vδ2T细胞不同,Vδ1T细胞既不响应氨基双膦酸盐(N-BP)也不响应磷酸抗原(pAg)介导的刺激。已经开发出利用植物有丝分裂原、细胞因子和辐照饲养细胞成功扩增Vδ1T细胞的方案,其中一些进入临床试验阶段。
最近的证据表明,产生IL-17的Vδ1T细胞促进肿瘤进展,且临床级N-BP和pAg可用并被批准用于人类的事实,Vδ2T细胞已成为临床开发的主要焦点。人类Vδ2细胞通常与T细胞受体TCRγ9配对,也称为vγ9vδ2T细胞。vγ9vδ2T细胞是人外周血单个核细胞(PBMCs)中主要的γδT亚群。vγ9vδ2TCR识别磷酸化抗原(PAgs),如在肿瘤细胞中积累的异戊烯基焦磷酸(IPP)和微生物感染过程中产生的(E)-4-羟基-3-甲基-但-2-烯基焦磷酸(HMBPP)。
尽管γδT细胞以MHC独立的方式结合PAgs,但PAgs介导的vγ9vδ2T细胞激活需要嗜丁酸蛋白(BTN)和BTN样分子,有研究报道BTN2A1与BTN3A1相关,二者启动向vγ9vδ2T细胞的抗原递呈。除了TCR相关抗原识别外,vγ9vδ2T细胞还表达NK受体,包括NKG2D和DNAM1和肿瘤细胞上广泛表达的MHC I类链相关分子(MICA, MICB)、ULBPbinding蛋白(ULBPs)和Nectin-like-5等受体(图3)(4)。

图3:γδT表面受体
使用基于γδT细胞的免疫疗法的临床试验试图在体内通过直接施用刺激剂或在体外通过收集和刺激外周血单核细胞中的γδT细胞来扩增Vδ2T细胞。因为调节性T细胞的脱靶扩增和与细胞因子治疗相关的剂量限制性毒性使用N-BP、唑来膦酸盐和细胞因子IL-2的组合在体内扩增γδT细胞已被证明是困难的;γδT细胞已经在过继细胞移植的背景下进行了研究,在过继细胞移植中,自体细胞在体外扩增到一定数量后,重新输注到患者体内(2)。
在同种异体γδT细胞免疫疗法的发展中,扩大来自PBMC的临床相关γδT细胞数量仍然是一个重大挑战。国卫生物自主研发,采用因子诱导,无血清培养,获得高纯度的γδT细胞体系,现已完成临床转化。
T细胞与嵌合抗原受体(CAR)的转导能够靶向细胞外结构域,从而以不依赖MHC的方式诱导CAR诱导的T细胞细胞毒性和细胞因子的产生,靶向B细胞抗原CD19的自体CAR-T细胞已被批准用于急性淋巴细胞白血病(ALL)和非霍奇金淋巴瘤(NHL),在大量预处理的患者中显示出高缓解率,其中一些患者得到持久缓解。尽管如此,许多患者对CAR-T细胞没有反应或经历复发,包括在一些患者中转移的T细胞丢失,以及在另一些患者中靶抗原表达或密度的改变等。
携带γδT细胞受体(γδT)的淋巴细胞是外周血细胞毒性T细胞的一小部分,它们不需要MHC分子的抗原呈递来识别和发挥功能,并且γδT细胞可以跨越MHC屏障,并且不会引起移植物抗宿主疾病,在临床前研究和早期临床试验中,扩增的vγ9vδ2T细胞被证明是具有抗肿瘤活性的。由于γδT细胞可以安全地应用于同种异体环境中,并表现出天然的抗肿瘤反应性,因此用CAR武装γδT细胞可能提供了一种安全使用同种异体CAR的方法,并且可以潜在地靶向抗原密度较低的小克隆,这些克隆可能无法被标准CAR-T细胞消除,研究发现,γδCAR-T细胞在体内和体外对CD19恶性肿瘤有效,并且对缺乏CD19表达的白血病克隆具有活性(图4)(3)。

图4:(A)14天后,未经治疗或未经转导的γδT细胞、γδCAR-T细胞或sCAR-T细胞处理的nsg小鼠骨髓中CD45+CD10+的人白血病(Nalm6);(B)未治疗或单独使用唑来膦酸钠(Zol)、Zol与γδCAR-T细胞、Zol与γδCAR-T细胞或重复剂量Zol和γδCAR-T细胞治疗的nsg小鼠骨髓中CD45+ CD10+的人白血病细胞(Nalm6);(C)在小鼠骨髓和脾脏注射注sCAR-T、γδCAR-T和未转导的γδT细胞,3天后,人效应细胞持久性。
γδT细胞是一种很有前途的细胞产物,可用于过继性癌症免疫治疗,目前基于γδT的细胞疗法主要有四种(图5):细胞因子激活的γδT细胞体外过继转移或体内局部给药;联合治疗包括γδT细胞转移联合特异性抗体治疗、免疫检查点阻断、化疗和纳米颗粒;双特异性抗体同时结合γδT细胞和癌细胞;基因修饰的CAR-γδT细胞直接识别癌细胞并介导癌细胞裂解。

图5:γδT细胞免疫疗法
自2017年以来,γδT细胞临床试验的数量急剧增加。首个CAR-γδT的临床试验于2017年在中国启动。之后,又开始了10种CAR修饰的γδT细胞疗法,一项基因修饰的研究专注于增加γδT淋巴细胞的化学耐药性(NCT04165941),以及一项应用TCR-T细胞技术的研究,该技术将肿瘤细胞毒性γδTCR转化为αβT细胞(NCT04688853)。
除了直接操纵T细胞外,Vγ9Vδ2T细胞活化抗体的使用,无论是人源化抗BTN3A抗体(NCT04243499)还是工程化肿瘤-γδTCR双特异性抗体(NCT05369000,NCT04887259),在过去两年中成为一种新的趋势。γδT细胞免疫疗法在临床上是安全的,并且可以实现异体回输,作为现货型产品。作为有希望治愈肿瘤的新兴疗法,γδT细胞疗法仍然面对肿瘤治疗中的“硬骨头”——肿瘤微环境,还有很多需要改进和测试的工作需要做,比如如何突破肿瘤微环境对CAR-γδT的限制,增加浸润等问题,国卫生物自主研发的γδT培养方案势必会助力γδT在肿瘤治疗中的临床研究,为患者带来更多希望。
参考文献:
1. Gao Z, Bai Y, Lin A, Jiang A, Zhou C, Cheng Q, Liu Z, Chen X, Zhang J, Luo P. Gamma delta T-cell-based immune checkpoint therapy: attractive candidate for antitumor treatment. Mol Cancer. 2023 Feb 15;22(1):31. doi: 10.1186/s12943-023-01722-0. PMID: 36793048; PMCID: PMC9930367.
2. Characterization of Donor Variability for γδ T Cell ex vivo Expansion and Development of an Allogeneic γδ T Cell Immunotherapy doi:10.3389/fmed.2020588453
3. Rozenbaum M, Meir A, Aharony Y, Itzhaki O, Schachter J, Bank I, Jacoby E, Besser MJ. Gamma-Delta CAR-T Cells Show CAR-Directed and Independent Activity Against Leukemia. Front Immunol. 2020 Jul 2;11:1347. doi: 10.3389/fimmu.2020.01347. PMID: 32714329; PMCID: PMC7343910.
4. Targeting Cytokine Signals to Enhance γδT Cell-Based Cancer Immunotherapy doi:10.3389/fimmu.2022.914839
5. Front Immunol. 2023; 14: 1202950. Published online 2023 Aug 15. doi: 10.3389/fimmu.2023.1202950 Figure1
