
编者按
肝细胞癌晚期治疗已经进入靶向和免疫治疗时代,靶免联合方案已经成为一线标准,更多的联合方案仍在探索中。在刚刚落下帷幕的2024年美国临床肿瘤学会(ASCO)年会上,抗PD-L1+抗CTLA-4的双免治疗CheckMate 9DW研究宣布获得积极结果,“双子星”方案有望跻身一线治疗。此外,这次大会上还公布了首个一线免疫治疗失败后使用ICI+TKI二线治疗的II期临床试验的结果;我国学者则报告了特异性自体armored-CAR-T细胞治疗的I期临床试验。
纳武利尤单抗联合伊匹木单抗对比仑伐替尼或索拉非尼作为不可切除肝细胞癌一线治疗的首次结果:来自CheckMate 9DW研究[1]背景
PD-L1抑制剂已经成为不可切除肝细胞癌(uHCC)一线治疗的标准方案(SOC),并显示出相比索拉非尼更好的疗效。然而这些患者的预后仍然较差,需要具有长期获益的替代疗法。在CheckMate 040研究中,对于接受过SOR治疗的肝细胞癌患者,纳武利尤单抗(NIVO)+伊匹单抗(IPI)二线治疗显示出具有临床意义的疗效和可控的安全性,因此在美国获得了加速批准。此处报告了关于III期、开放标签、随机临床试验CheckMate 9DW研究的预设中期分析的初步结果,该试验评估了NIVO+IIPI对比仑伐替尼(LEN)或索拉非尼(SOR)作为未接受治疗的肝细胞癌患者一线治疗的有效性和安全性(NCT04039607)。
方法
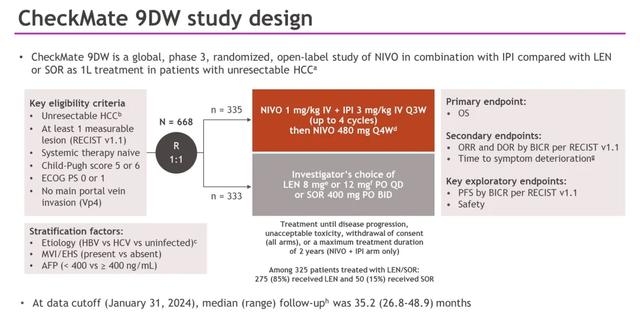
纳入研究的人群为成人肝细胞癌患者,这些患者既往未接受过治疗,不适合接受根治性手术或局部区域治疗,Child-Pugh评分为5-6,且ECOG体能状态评分为0-1。患者被随机分配(1:1)接受纳武利尤单抗(NIVO)1 mg/kg+伊匹单抗(IPI)3 mg/kg,每3周一次(最多4个周期),随后接受纳武利尤单抗(NIVO)480 mg,每4周一次;或研究者选择的仑伐替尼(LEN)8 mg或12 mg,每日一次;或索拉非尼(SOR)400 mg,每日两次,直至疾病进展或出现不可接受的毒性。纳武利尤单抗(NIVO)的给药时间最长为2年。主要终点是总生存期(OS)。次要终点包括根据RECIST v1.1版本进行盲法独立中心审查(BICR)的客观缓解率(ORR)和缓解持续时间(DOR)。
结果
共有668名患者被随机分配到纳武利尤单抗(NIVO)+伊匹单抗(IPI)(n=335)或仑伐替尼(LEN)/索拉非尼(SOR)(n=333)组;在LEN/SOR组接受治疗的325名患者中,有275名(85%)接受了仑伐替尼(LEN)。基线特征见下图。

经过中位(范围)35.2(26.8–48.9)个月的随访后,NIVO+IPI组患者的中位总生存期(OS)为23.7个月,而LEN/SOR组患者的中位OS为20.6个月(HR 0.79;95%CI:0.65~0.96;P=0.0180),两组的24个月OS率分别为49%(44%-55%)和39%(34%-45%)。NIVO+IPI组的ORR高于LEN/SOR组(36% vs. 13%;P<0.0001);NIVO+IPI组有7%的患者观察到完全缓解(CR),而LEN/SOR组仅有2%的患者观察到CR。NIVO+IPI组的中位DOR为30.4个月,而LEN/SOR组为12.9个月。



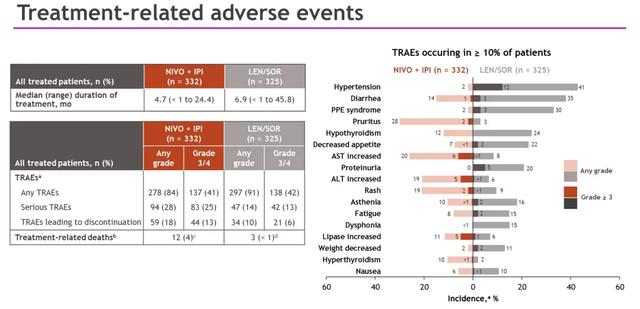
治疗相关不良事件(TRAEs)的总结见下图。NIVO+IPI组和LEN/SOR组的3/4级TRAE发生率分别为41%和42%;严重TRAE发生率分别为28%和14%;停药率分别为18%和10%。
结论
对于既往未经治疗的uHCC患者,纳武利尤单抗+伊匹木单抗与乐伐替尼/索拉非尼相比,显示出具有统计学意义的OS显著获益,以及更高的ORR和更加持久的缓解,且安全性可控。这些结果支持该组合作为未接受治疗的晚期肝细胞癌的潜在新一线标准治疗方案。
一项瑞戈非尼联合帕博利珠单抗用于既往接受过免疫检查点抑制剂(ICI)治疗晚期肝细胞癌(HCC)患者的国际性、开放标签II期研究[2]背景
对于仅接受过一次免疫检查点抑制剂(ICI)治疗后疾病进展的晚期肝细胞癌(HCC)患者,尚未确定最佳二线治疗方案。瑞戈非尼已获准用于索拉非尼治疗后的晚期HCC。本研究的主要目的是评估瑞戈非尼联合帕博利珠单抗在仅接受过一次ICI方案治疗后疾病进展的晚期HCC患者中的疗效。
方法
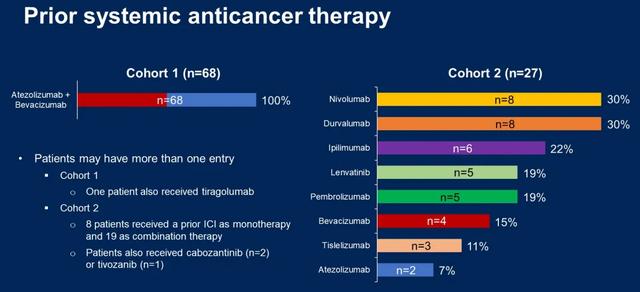
年龄在18岁及以上、Child-Pugh分级A级、巴塞罗那临床肝癌分期(BCLC)B或C期、东部肿瘤协作组体能状态评分(ECOG PS)为0或1的患者接受了口服瑞戈非尼90 mg,每日一次,每3周(wk)服用/停药1周,同时接受静脉注射帕博利珠单抗400 mg,每6周一次。如果耐受,瑞戈非尼的日剂量可以在瑞戈非尼的第一个4周周期后增加至120 mg。不允许减少帕博利珠单抗的剂量。根据先前的治疗将患者分为两组:队列1=阿特珠单抗+贝伐珠单抗;队列2=任何其他ICI方案(单独或组合)。主要终点是通过独立中心评审(RECIST 1.1)的总体缓解率(ORR)。
结果
共纳入95名患者,分布在8个国家;队列2具有更有利的疾病特征。队列2中既往用过的ICI最常见的是度伐利尤单抗(30%)、纳武利尤单抗(30%)、伊匹单抗(22%)和帕博利珠单抗(19%)。

中位随访期为7.1个月,队列1与队列2相比,瑞戈非尼/帕博利珠单抗治疗的中位持续时间(包括中断、延迟)更短(11.0/9.4周 vs. 21.4/24.1周)。队列1的ORR为5.9%,队列2的ORR为11.1%;疾病稳定(SD)率分别为48.5%和63.0%。队列1的中位无进展生存期(PFS)为2.8个月,队列2为4.2个月。两个队列的OS均未到达。


总体而言,56%的患者出现了3级治疗期间出现的不良事件(TEAE),5%的患者出现了4级TEAE;药物相关的3级和4级TEAE分别发生在37%和3%的患者中。1名患者(队列1)出现了5级药物相关的TEAE(心搏骤停)。最常见的药物相关TEAE是手足皮肤反应综合征(39%)、乏力(33%)、食欲下降(32%)、腹泻(28%)和高血压(20%)。评估基线和第6周/第6天的配对活检组织中的生物标志物,结果显示在接受治疗期间,巨噬细胞和血管生成RNA标志物有所减少。

结论
这是首个对一线ICI治疗后HCC患者使用激酶抑制剂加ICI进行前瞻性评估的临床试验。瑞戈非尼联合帕博利珠单抗在一线ICI方案后的二线治疗中显示出适度的疗效。该组合的安全性与这两种药物各自的安全性一致。一线ICI方案后进展的晚期HCC患者的最佳治疗方案仍然是一个未满足的需求。
特异性自体armored-CAR-T细胞治疗C-CAR031用于晚期肝细胞癌患者的I期研究[3]背景
背景:GPC3是一种在肝细胞癌(HCC)中过度表达的表面抗原,在健康组织中几乎不存在。靶向GPC3的嵌合抗原受体(CAR)T 细胞为晚期不可切除HCC治疗提供了一种有希望的选择。C-CAR031是一种靶向GPC3的自体CAR-T细胞疗法,配备有显性负性TGF-β受体II。此处报告了C-CAR031在晚期HCC患者中的安全性和初步疗效。

方法
这是首次人体、开放标签的剂量递增试验,采用了加速滴定加i3+3设计。对一线系统治疗失败的GPC3阳性晚期HCC患者在接受标准淋巴清除后,接受单次C-CAR031静脉输注。主要终点是安全性和耐受性,其他终点包括药代动力学和初步疗效。不良事件(AEs)按照CTCAE 5.0进行分级,细胞因子释放综合征(CRS)/免疫效应细胞相关神经毒性综合征(ICANS)根据ASTCT 2019标准进行评估。客观反应由研究者根据RECIST 1.1标准进行评估。

结果
截至2024年1月5日,共有24名患者接受了4个剂量水平(DLs)的C-CAR031输注。所有患者均患有BCLC C期HCC,其中83.3%(20/24)存在肝外转移。中位既往治疗线数为3.5(范围:1-6),23(95.8%)名患者接受了免疫检查点抑制剂(ICIs)和酪氨酸激酶抑制剂(TKIs)。
所有患者均可评估安全性。未观察到剂量限制性毒性和免疫效应细胞相关神经毒性综合征(ICANS)。在22(91.7%)名患者中观察到CRS,其中仅1(4.2%)名患者为3级CRS。最常见的≥3级AEs包括淋巴细胞减少症(100%)、中性粒细胞减少症(70.8%)、血小板减少症(37.5%)和转氨酶升高(16.7%)。在DL4剂量水平下,1名患者(4.2%)出现4级骨髓抑制,1名患者(4.2%)因3级CRS导致3级间质性肺炎。所有AEs都是可逆的。

22名患者可用于评估疗效。在90.9%的患者中观察到肿瘤缩小,不仅限于肝内病变,还包括肝外病变,中位缩小42.2%(范围,3.4%-94.4%)。疾病控制率为91.3%;所有剂量水平患者的ORR为56.5%;在DL4剂量水平下,ORR为75.0%。

结论
该研究显示,在经过多次治疗的晚期HCC患者中,C-CAR031具有可控的安全性特征和鼓舞人心的抗肿瘤活性。
参考文献:
[1]Peter Robert Galle, Nivolumab (NIVO) plus ipilimumab (IPI) vs lenvatinib (LEN) or sorafenib (SOR) as first-line treatment for unresectable hepatocellular carcinoma (uHCC): First results from CheckMate 9DW.J Clin Oncol 42, 2024 (suppl 17; abstr LBA4008)
[2]Anthony B. El-Khoueiry, er al. International, open-label phase 2 study of regorafenib plus pembrolizumab in patients with advanced hepatocellular carcinoma (HCC) previously treated with immune checkpoint inhibitors (ICI).J Clin Oncol 42, 2024 (suppl 16; abstr 4007)
[3]Qi Zhang, Phase I study of C-CAR031, a GPC3-specific TGFβRIIDN armored autologous CAR-T, in patients with advanced hepatocellular carcinoma (HCC).J Clin Oncol 42, 2024 (suppl 16; abstr 4019)
