------“”,加星标,长期关注本科普号。
人生小哲理所有的付出,本质上都是得到
正文● ● ●
矽肺是由于长期吸入高浓度的游离二氧化硅引起的,是中国死亡率和发病率最高的一种尘肺病。尽管矽肺有明确的病因,但其发病机制复杂,目前尚无有效的治疗方法。因此,迫切需要找到一种可能有效的治疗方法。
矽肺的特点是硅结节和肺纤维化(PF)。PF的特点是肺实质的破坏,细胞外基质(ECM)的沉积,以及纤维细胞和肺泡上皮细胞表型的巨大变化。成纤维细胞的激活被认为是驱动PF纤维化进展的主要因素,抑制成纤维细胞的激活也可以影响各种治疗策略的效果。
而外泌体是由细胞内多泡体(multivesicular body,MVB) 与细胞膜融合后,释放到ECM中的膜性囊泡,大小为40-150nm。多种类型细胞均可以分泌外泌体,这些外泌体将功能蛋白、mRNA和/或microRNA(miRNA)转移到受体细胞。外泌体介导的物质转移已被认为是细胞间交流的一个重要途径。
最近的研究表明:间充质干细胞可以分泌外泌体来修复PF。以往研究中也发现:来自三维培养的脐带间充质干细胞外泌体(hucMSCs-Exos)可以改善硅诱导的小鼠PF模型的PF水平。

原文链接:
https://www.sciencedirect.com/science/article/pii/S0147651322001427
1
外泌体制备及评估
本实验旨在评估hucMSC-Exos对成纤维细胞激活的影响,对照组采用来自MRC-5的外泌体(MRC-5-Exos),两种外泌体均基于三维动态培养方法获得(图1:A/B),并进行了TEM(图1:C/F)、NTA(图1:D/G)、标志物的检测(图1:E/H)。

图1.细胞的三维培养和外泌体的鉴定
▌A: 3D FloTrix® miniSpin生物反应器
▌B: hucMSCs和MRC-5细胞的3D培养。
▌C/F:用TEM捕捉外泌体的图像。
▌D/G:通过NTA,平均颗粒的大小分别显示为123.9和133.5纳米。
▌E/H:通过Western印迹检测到CD81、CD63和TSG101在外泌体中的表达,Calnexin(一种阴性标记)在外泌体中的表达量很小;然而,通过Western印迹检测,它在hucMSCs和MRC-5细胞中的表达量相对较高。
2
外泌体治疗方法及检测指标
为了比较激活成纤维细胞和PF的抑制作用,我们在小鼠的矽肺模型中进行了研究,用hucMSC-Exos或MRC-5-Exos治疗30天。
当成纤维细胞被激活并转化为肌成纤维细胞时,细胞会分泌过多的细胞外基质蛋白,以及α-平滑肌作用(α-SMA)、胶原蛋白I和纤连蛋白(FN)的表达,这可以作为肌成纤维细胞存在的指标,所以我们检测了小鼠肺部的α-SMA、胶原蛋白I和FN的蛋白表达水平。
3实验结果与对照组相比,hucMSCExos处理后,二氧化硅增加的HYP和α-SMA、I型胶原和FN水平的蛋白表达明显降低。说明,hucMSC-Exos具有抑制小鼠成纤维细胞的活化和减轻二氧化硅诱导的小鼠PF的潜在作用(图2)
使用免疫荧光染色确定hucMSC-Exos或MRC-5-Exos均可被小鼠胚胎成纤维细胞(NIH-3T3)细胞内化(图2)

图2. HucMSC-Exos抑制成纤维细胞活化
以缓解硅诱导的小鼠PF的作用
▌A: 在hucMSC-Exos或MRC-5-Exos治疗后,小鼠注入二氧化硅的实验过程。
▌B: 小鼠肺的H&E和Masson染色(200×和400×)。
▌C: Masson染色阳性胶原纤维的百分比。
▌D: HYP的含量。
▌EF:采用Westernblot法检测四组小鼠I型胶原和FN型胶原沉积标志物的表达。数据以每组的平均值± SD,n = 3表示。* P < 0.05(与对照组相比),# P < 0.05(与二氧化硅组相比)。
与对照组相比,硅组α-SMA、I型胶原和FN表达上调;而硅hucMSC-+组(硅+MRC-5-Exos组)α-SMA、I和FN型胶原水平较硅组降低。说明,hucMSC-Exos抑制了二氧化硅对NIH-3T3细胞中诱导的成纤维细胞的活化(图3)
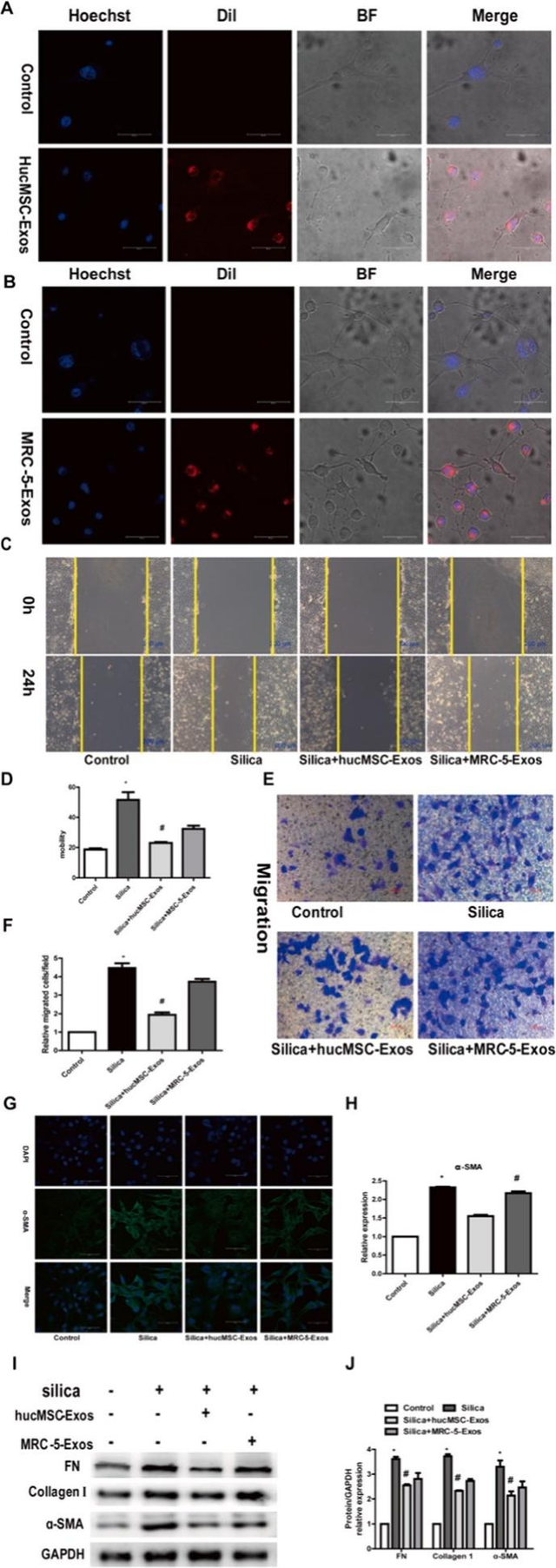
图3.HucMSC-Exos抑制了成纤维细胞的活化
▌A/B:在体外跟踪hucMSC-Exos或MRC-5-Exos,用Dil红色荧光染料(Dil:激发=549nm;发射=565nm)来标记hucMSC-Exos或MRC-5-Exos。使用Hoechest蓝色荧光染料来标记细胞核。
▌BF:明场。
▌C/D:伤口愈合试验。
▌E/F:Transwell试验。
▌G/H:对NIH3T3细胞中α-SMA的免疫荧光染色(绿色)和半定量分析。
▌I/J:通过Western blotting检测NIH-3T3细胞中hucMSC- Exos的α-SMA、胶原I和FN的表达,每组n=3,* P<0.05(与对照组相比),# P<0.05(与二氧化硅组相比)。
新一代测序技术分析了hucMSCs-Exos和MRC-5-Exos之间不同表达的miRNAs。我们发现miRNA let-7i-5p和TGFβ受体1(TGFBR1)之间的相互作用参与了PF。Let-7i-5p负责激活成纤维细胞,TGFBR1有一个保守的3′与let-7i-5p互补的同源序列(UTR)。因此,推测TGFBR1可能作为硅活化成纤维细胞中hucMSC-Exos中let-7i-5p的潜在靶点(图4)。

图4. 外泌体-miRNAs的不同表达和基因富集的分析
▌A: 差异miRNA表达的火山图。
▌B: 差异miRNA表达的热图。
▌C: 靶基因预测结果的维恩图谱。
▌D: 候选靶基因KEGG通路的气泡图谱。
▌E: 与纤维化疾病相关的差异miRNA表达。
▌F: 在纤维化疾病小鼠中的差异表达miRNAs(DEmiRNA)的验证。
▌G: let-7i-5p的候选靶基因。
▌H: TGFBR1 3结合位点示意图′-UTR到let-7-5p和TGFBR1 3的突变′-UTR。
▌G: 在转染了let-7i-5p模拟物和TGFBR1 3的细胞中,检测了TGFBR1的荧光素酶活性′-UTR质粒。数据以平均± SD(n = 3)表示。* P <0.05(与对照组相比)。
由于TGFBR1与let-7i-5p结合,研究者发现hucMSC-Exos是否干扰了TGFβ 1通路,预测hucMSC-Exos介导的let-7i-5p有助于TGFBR1的活性。正如预期的那样,IHC和Western blotting的结果显示,小鼠暴露于二氧化硅后,TGFBR1和磷酸化Smad3(P-Smad3)的水平增加,在用hucMSC-Exos处理后,其水平下降,但用MRC-5-Exos处理后,TGFBR1和P-Smad3的水平并没有改变。说明,TGFBR1/Smad3信号通路与小鼠和NIH-3T3细胞中硅诱导的PF相关(图5)。

图5.在小鼠和NIH-3T3细胞中,与硅诱导的PF相关的TGFBR1/Smad3信号通路
▌A-D:采用IHC和免疫印迹法检测小鼠TGFBR1和P-Smad3水平。
▌E/F:免疫印迹法检测NIH-3T3细胞中TGFBR1和P-Smad3的水平。所有数据均以平均± SD(n = 3)表示。*P<0.05(与对照组相比)和#P<0.05(与二氧化硅组相比)。
为了证明let-7i-5p在hucMSC-Exos介导纤维化过程中的调控作用,在hucMSCs中使用其抑制剂对let-7i-5p进行基因修饰。荧光素酶报告基因分析表明,let-7i-5p以TGFBR1为靶点。免疫印迹法检测NIH-3T3细胞中α-SMA、I型胶原、 FN、TGFBR1和PSmad3的水平。结果显示,与硅+hucMSC-Exos-let-7i-5p抑制剂组相比,硅+hucMSC-Exos-let-7i-5p抑制剂+siRNA TGFBR1组中α-SMA、I型胶原、FN、TGFBR1和P-Smad3蛋白水平降低(P < 0.05)。说明,hucMSC-Exos let-7i-5p通过TGFBR1调控NIH-3T3细胞中P-Smad3的激活,并抑制成纤维细胞的激活(图6)。

图6.HucMSC-Exos let-7i-5p通过TGFBR1/Smad3信号通路抑制NIH-3T3细胞中成纤维细胞的激活。
▌A: 不同诱导剂处理let-7i-5p的实验过程。
▌B: 采用RT-qPCR,检测let-7i-5p的表达。
▌C/D:采用免疫印迹法,检测α-SMA、I型胶原、FN、TGFBR1和P-Smad3的相对蛋白水平。*P<0.05(与对照组相比),#P<0.05(与二氧化硅组相比),&P<0.05(与二氧化硅hucMSC-Exos组相比)。
▌E: 不同诱导剂处理TGFBR1或Smad3 siRNA的实验过程。
▌F/G:采用免疫印迹法,检测α-SMA、I型胶原、FN、 TGFBR1和P-Smad3的相对蛋白水平。* P < 0.05(与对照组相比),# P < 0.05(与二氧化硅组相比),&:P < 0.05(与二氧化硅hucMSC-Exos组相比),^:P < 0.05(与二氧化硅+ hucMSC-Exos let-7i-5p抑制剂组相比)
▌H/I-hucMSC-Exos let-7i-5p抑制剂组:采用免疫印迹法,检测α-SMA、I型胶原、FN和P-Smad3的相对蛋白水平。每组n = 3,*P<0.05(与对照组相比),#P<0.05(与二氧化硅组相比)。
4讨论展望外泌体的细胞间转移是一种成熟的介导细胞间通信的机制,其由质膜分泌并进行自由运输。一些证据来源支持细胞外miRNA分泌现象,miRNA(和外泌体)的细胞间通信不仅存在于同一生物体的细胞之间,也存在于不同的生物体之间。在研究中,已经证实这些外泌体可以被成纤维细胞吸收。
Let-7是最早发现的miRNA之一,其家族是最大的miRNA家族之一。hucMSC-Exos中的let-7i-5p可能干扰TGF-β信号通路以阻断纤维化,从而进一步改变它们的基因表达表型和谱。
TGFβ 1是PF最有效和研究最充分的诱导剂之一,它可以激活成纤维细胞,促进ECM的产生。抑制TGFBR1可以预防或减少不同组织的纤维化,从而导致Smad3磷酸化水平降低。在研究中, Smad3在二氧化硅诱导的成纤维细胞的激活中也发挥了重要作用。GFBR1作为一种丝氨酸/苏氨酸激酶被激活,它可以磷酸化细胞质中的Smad3(P-Smad3)。P-Smad3是Smad3激活的主要形式。在没有Smad3基因的小鼠中,可以观察到P-Smad3信号的显著衰减。TGF-β触发了Smad3的激活和磷酸化。
综上所述,二氧化硅暴露诱导小鼠和NIH-3T3细胞中let-7i-5p水平降低,三维培养hucMSC-Exos可通过靶向TGFBR1使let-7i-5p进入成纤维细胞,导致Samd3水平降低。最终减少了由二氧化硅诱导的成纤维细胞的活化。因此,三维培养hucMSC-Exos可通过抑制成纤维细胞的活化,对二氧化硅诱导的PF患者起到积极的治疗作用 。
— END —

- 科普 情怀 责任 -
