近些年来,120万一针的CAR-T疗法的余热未退去,另外一种针对实体瘤的新型细胞免疫疗法——肿瘤浸润淋巴细胞(TIL)疗法又掀起新的抗癌热潮。
TILs于1986年被Rosenberg等学者首次报道,是近年来肿瘤免疫学领域的研究热点之一。此疗法可以说是一种“古老”的细胞疗法,拥有30多年的历史,即从患者的肿瘤中分离出淋巴细胞,将分离的细胞在体外激活扩增或加以改造,然后再回输到患者体内。
TILs疗法最早被用于恶性黑色素瘤,国内外多项研究表明,该疗法在卵巢癌、三阴性乳腺癌、非小细胞肺癌、胃肠道肿瘤、头颈癌、宫颈癌等实体瘤中均有不俗的疗效。2024年2月16日,Lifileucel(LN-144)获得美国食品和药物管理局(FDA) 批准上市,用于治疗PD-1抗体治疗后进展的晚期黑色素瘤,成为全球首款获批上市的TIL疗法,也是全球首款获批的用于治疗实体瘤的T细胞疗法,具有里程碑的意义!
国内方面,多家公司公布了TIL管线临床获批的好消息。整体而言,能够感受到TIL赛道的热度在持续上升并日趋白热化。今天无癌家园小编就给各位癌友们介绍君赛生物自主研发的TIL细胞产品。
登上《解放日报》,全球首款无需清淋TIL疗法治疗复发难治性癌症大显身手!
就在6月18日的《解放日报》上也刊登了君赛生物研发的基因修饰TIL疗法的相关报道,君赛生物公司研发的基因修饰TIL(肿瘤浸润淋巴细胞)疗法Ⅰ期临床试验已启动。目前,这家上海企业已有GC101、GC203两款TIL细胞疗法进入临床试验,在宫颈癌、卵巢癌、胰腺癌等9种不同类型的晚期实体肿瘤中均显示出疗效。
研究人员称,如果临床试验进展顺利,GC101有望2026年获批上市,并通过“平民价”让TIL疗法造福越来越多的癌症患者。
GC101TIL是君赛生物自主开发的“自体天然肿瘤浸润淋巴细胞注射液,2022年4月24日正式获得国家药品监督管理局(NMPA)的临床试验默示许可。

图源来自NMPA官网
创新型GC101TIL疗法与Iovance公司获批上市的AMTAGVI™(Lifileucel)不同,所有患者仅需入住普通病房即可接受治疗,TIL细胞回输前无需接受高强度清淋预处理,TIL细胞回输后无需输注任何剂量的IL-2,简化后的临床方案仍可保证TIL细胞在患者体内有效增殖,极大避免AMTAGVI™黑框警告相关不良反应(如:治疗相关死亡事件、持续性严重细胞减少症、严重感染、心肺功能和肾功能损伤等)发生风险,大幅提高TIL疗法安全性、便捷性及可及性。
目前,据君赛生物最新透露的消息,君赛生物自体天然TIL细胞注射液GC101的临床Ⅰ期试验正在国内8家权威三甲医院开展,并取得了显著的疗效。
GC101针对恶性黑色素瘤、宫颈癌、肺癌等多种类型晚期实体肿瘤的客观缓解率超35%,已有4例患者肿瘤完全缓解(CR),其中无瘤生存最久时间已近3年,未发生与治疗相关的严重不良反应,大幅提高TIL疗法的安全性、适用性与可及性。
不止在多种类型的晚期实体瘤方面有明显疗效,2024年5月20日,君赛生物与上海第十人民医院妇产科程忠平主任团队在《BMC Medicine》杂志上发表了“关于无需IL-2的TIL疗法联合PD-1在治疗晚期妇科癌症方面显示出明显疗效”的创新研究成果。这也是全球第一项未联用IL-2,并取得良好疗效的TIL疗法临床报道,具有重大的突破意义。

图源来自NCBI官网
该研究共招募了16例患有晚期妇科癌症的患者并接受了TIL输注。大多数患者在病灶切除后7天或更短时间内出院并进行TIL培养。研究者们成功地从所有入选患者中扩增了TIL,表明从复发性妇科癌症患者中扩增TIL的方案是可行的。遗憾的是,有2例患者因2019年的COVID-19大流行而失访。
在 14 例可评估患者中,6 例被诊断为卵巢癌,5 例被诊断为宫颈癌,2 例被诊断为子宫内膜癌,1 例被诊断为腹膜癌。患者中位年龄为 51.5 岁(范围 33-65 岁)。患者平均有 3.4 个病灶,其中大多数为巨大病灶,靶病灶直径平均总和为 43.6 毫米。患者的中位 ECOG 体能状态评分为 2分(范围 1-3)。患者平均接受了 3.4 线全身治疗,6 例(42.9%)患者在 TIL 治疗前接受过抗 PD-1 或 CTLA4 抗体治疗。对于所有 14 例可评估患者,TIL 均成功扩增并输注,中位剂量为 209 亿淋巴细胞(范围 12.5-50.5),中位CD3 + T 淋巴细胞为 71% CD8 +(范围 5%-97%)。
经TIL细胞回输治疗后,在 14 名可评估患者中,研究者评估的客观缓解率( ORR)为 35.7% (5/14),疾病控制率(DCR)为 71.4% (10/14),其中 3 例 (21.4%) 患者完全缓解 (CR),2 例 (14.3%) 患者部分缓解 (PR),5 例(35.7%) 患者病情稳定 (SD)。三次完全缓解分别持续了 19.5、15.4 和 5.2 个月,如图所示。
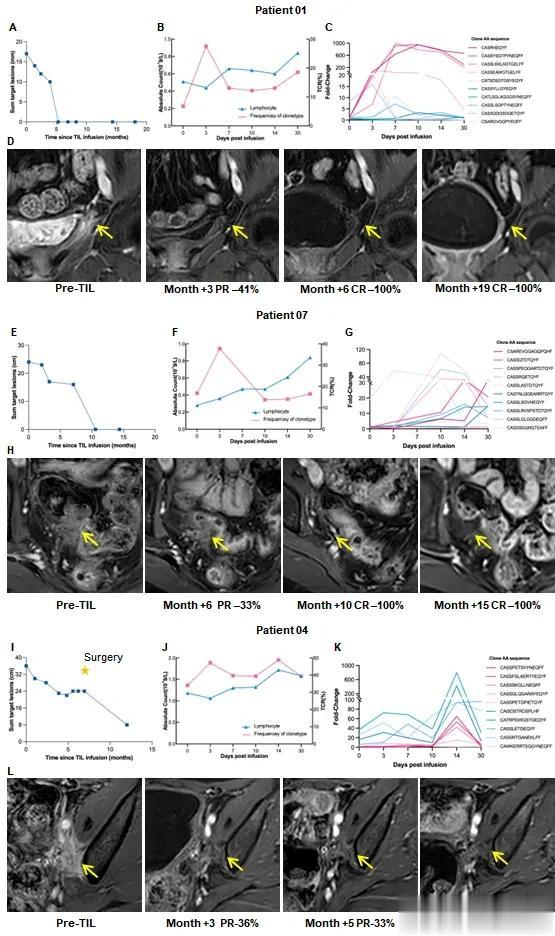
患者TIL回输前后的影像对比与TIL来源TCR克隆跟踪检测
患者01患有复发性宫颈癌并伴有膀胱转移,在 TIL 治疗后获得了超过 1.5 年的持续完全缓解。输注后,循环T细胞克隆型显著增加,与淋巴细胞一致。外源性T细胞克隆型和内源性T细胞克隆型增加,表明在肿瘤杀伤中起着主导作用。
同样,患者07患有复发性子宫内膜癌并伴有直肠转移,在接受 TIL 治疗后,她的完全缓解已持续1.5年。总共有 358 种 T 细胞克隆型增加了 10 倍以上,其中包括 240 种外源性 T 细胞克隆型和 118 种内源性 T 细胞克隆型。
患者04已确认有部分缓解,外源性T细胞克隆型有2052种,内源性T细胞克隆型有123种,增加了10倍。这些结果提示,输注的TIL中的一些T细胞克隆在体内大量增殖,并可能激活内源性肿瘤反应性T细胞来协同杀伤肿瘤。
此次研究证明,培养体系优化后的TIL细胞可以打破IL-2的依赖性,可以避免清淋级预处理的使用,并实现良好的临床疗效。让我们共同期待日后GC101将会给大家带来更多的惊喜!
目前君赛生物GC101治疗晚期实体瘤(包括但不限于:黑色素瘤、肺癌、宫颈癌、食管鳞癌、头颈部鳞癌、子宫内膜癌)的临床研究正在进行中
本文为无癌家园原创
