近日,联合采购办公室发布通知,第十批国家组织药品集中采购药品即将分阶段开展企业药品基础信息填报工作,第十批国家集采终于正式启动。第十批集采拟纳入62个品种、263个品规(以编号计),创历次集采之最。

这些品种涵盖了10个治疗大类,主要集中在心脑血管系统药物、全身用抗感染药物、消化系统及代谢药三大领域,分别涉及12、10、10个品种。
在消化系统及代谢化药领域,包括4个糖尿病用药、1个矿物质补充剂、1个胃肠解痉药/抗胆碱药/胃动力药、1个治疗便秘的药物、1个治疗与胃酸分泌相关疾病的药物、1个维生素类及1个止吐药/止恶心药。本次国采注射剂占据主导地位。62个品种中,注射剂有37个,占比接近60%;口服常释剂型也有19个品种入选,占比超过30%。
为做好第十批国家组织药品集中采购工作,进一步优化工作流程,建立常态化工作机制,自2024年11月1日起,联合采购办公室开展第十批国家组织药品集中采购相关药品信息填报工作,现将有关事项通知如下:
一、药品要求属于药品填报范围(详见附件)并获得国内有效注册批件且满足以下要求之一的上市药品,应具备相应批件或可在国家药品监督管理局药品审评中心《化学药品目录集》中查询到相应结果:
1. 国家药品监督管理部门发布的仿制药质量和疗效一致性评价参比制剂。
2. 通过国家药品监督管理部门仿制药质量和疗效一致性评价的仿制药品。
3. 根据《国家食品药品监督管理总局关于发布化学药品注册分类改革工作方案的公告》〔2016 年第 51 号〕或《国家药监局关于发布化学药品注册分类及申报资料要求的通告》〔2020 年第 44 号〕,按化学药品注册分类批准,并证明质量和疗效与参比制剂一致的仿制药品。
二、企业要求属于本次药品填报范围并满足药品要求的相关企业,包括:提供药品及伴随服务的国内药品生产企业,药品上市许可持有人,境外药品上市许可持有人境内代理人。上述所称的代理人,是指按照国家有关部门关于境外药品上市许可持有人境内代理人管理规定,取得我国药品注册证书的境外持有人依法指定,代表其履行法律法规规定的药品上市许可持有人义务的中国境内企业法人。
三、填报内容1. 生产企业、药品上市许可持有人、境外药品上市许可持有人境内代理人的证明材料(包括企业名称、统一社会信用代码、联系人、授权书等)。
2. 符合药品要求的证明材料(包括药品注册批件、补充注册批件、说明书等)。
3. 产能及原料药自产说明。
4. 企业委托生产、批件转让、关联关系信息等。
四、注意事项1. 填报方式:请登陆国家医保服务平台(网址:fuwu.nhsa.gov.cn,选择「药品和医用耗材招采服务」—「国家组织药品集中采购信息填报」—「企业登录」)进行填报,新用户需在登录页面点击「注册」,并按要求填写相关信息,完成平台账号注册;若已有平台账号,需要重新提交与本次集采相关的资质文件,待审核通过后方可进行「品种信息」维护。用户账号长期有效无需重复注册。
2. 审核通过的药品信息经企业确认将生成《申报信息一览表》,作为第十批国家组织药品集中采购的申报依据,请正确填写相关信息。具体要求以采购文件规定为准.
3. 联系方式:021-31773244、31773255、31773266
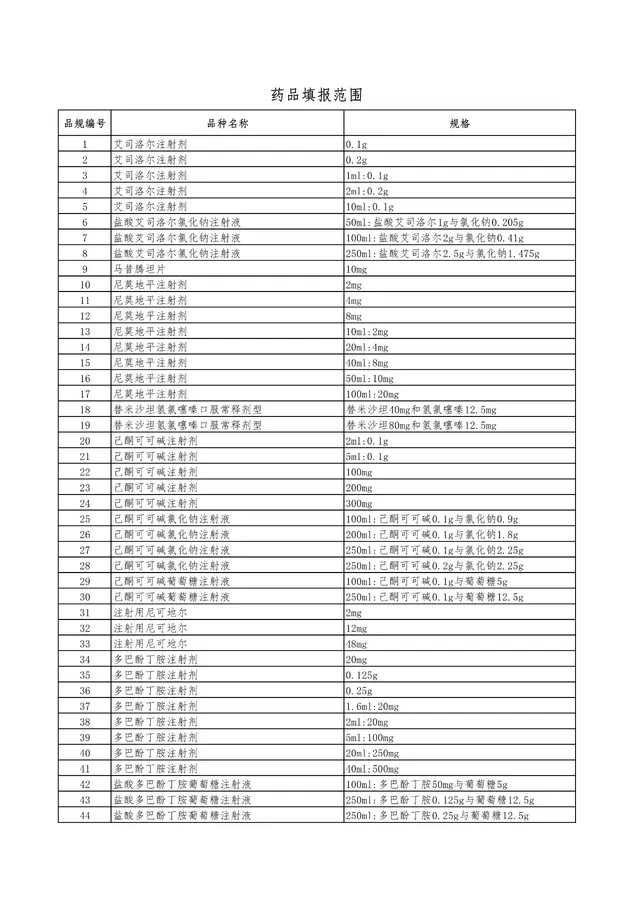
附件:药品填报范围





<END>
