
编者按
睾酮在前列腺癌的发生和发展过程中起着重要的作用,而前列腺癌的重要治疗方式雄激素剥夺治疗(ADT)的目标——血清睾酮去势水平已经定义了40多年,40多年前定义的治疗目标是否能满足当前前列腺癌管理的需求?深度降酮与更佳生存结局是否相关?如何优化管理方案以达到深度降酮?本期益腺学院特邀山东第一医科大学附属省立医院傅强教授,解读最新发表的研究,回顾已有循证证据,探讨前列腺癌患者深度降酮的意义,以期为临床实践提供参考。
专家简介

傅强 教授
山东省立医院泌尿外科主任 二级教授 博士生(后)导师
山东省有突出贡献的中青年专家
山东省医学会男科分会主任委员
山东省健康管理学会微创泌尿外科专业委员会主任委员
山东省中西医结合学会男科学分会主任委员
山东省老年医学会男科学分会主任委员
山东省抗癌协会理事、泌尿男生殖肿瘤专业委员会副主任委员
中华医学会男科学分会生殖内分泌学组副组长
中国医师学会男科与性医学会学委员
《中华男科学杂志》编委
美国杜克大学高级访问学者
研究方向:微创泌尿外科、泌尿男生殖系肿瘤及男科学
获山东省科技进步二等奖3项,山东省科技进步三奖2项。5项科研课题经鉴定达到国际先进水平。目前承担国家自然基金、山东省科技攻关课题和山东省自然基金各1项。
主编《肾脏外科学》、《临床前列腺病学》2部,副主编《实用临床男科学》,《微创泌尿外科》2部,参编著作等5部。第一作者或通讯作者发表SCI收录论著20余篇。
深度降酮带来长期生存获益前列腺癌是典型的激素依赖性肿瘤,睾酮在肿瘤的发生发展中起着重要的作用,将睾酮降至去势水平是治疗的重要目标。尽管目前国内外指南中去势水平仍然定义为血清睾酮<50 ng/dL(1.7 nmol/L)[1–3],但随着越来越多研究数据的出现,学界已逐渐认识到血清睾酮<20 ng/dL(0.7 nmol/L)或是更理想的去势水平,因其与更佳的疾病预后和更多的患者获益相关[4]。中国指南也推荐睾酮水平20ng/dL可以作为判断前列腺癌治疗预后及生存获益的观察点[3],因此进一步探讨深度降酮在前列腺癌治疗中的作用是十分必要的[1]。近日,BJUI Compass杂志发表了一项对曲普瑞林多项III期研究事后分析的结果,旨在探索晚期前列腺癌患者接受ADT治疗后睾酮水平最低值与临床结局的相关性[5]。
研究汇总了3项曲普瑞林单药治疗晚期前列腺癌的前瞻性、为期9-12个月的III期临床研究的数据,所使用的曲普瑞林包括1月、3月和6月剂型。主要终点为总生存期(OS)和疾病特异性生存期(DSS),按照血清睾酮水平最低值(NT)<10 ng/dL、10~20 ng/dL、20 ng/dL~50 ng/dL和≥50 ng/dL进行分层分析,通过Kaplan-Meier分析和对数秩检验评估不同NT组的OS和DSS。主分析的时间范围为第1~518天(中位OS随访时间为254天[范围29~518天]),敏感性分析的时间范围为第1~262天。次要终点还包括达到不同NT的患者比例、患者睾酮水平低于不同NT的时间等。
OS结果主分析的结果显示,NT<10 ng/dL组的OS率显著高于10 ng/dL≤NT<20 ng/dL组,20 ng/dL≤NT<50 ng/dL组和50 ng/dl≤NT组由于患者数过少而无法得出确定性的结论,但OS的趋势一致。敏感性分析同样验证了更低的睾酮水平与更高的OS率相关(图1)。

图1. 不同NT组OS的Kaplan-Meier曲线图
考虑到在第57天时分别有99%、95%和80%的患者可达到睾酮水平<50 ng/dL、<20 ng/d和<10 ng/dL,因此选择以第57天作为Landmark日期对不同NT组进行Landmark分析,结果也支持上述结论(图2)。
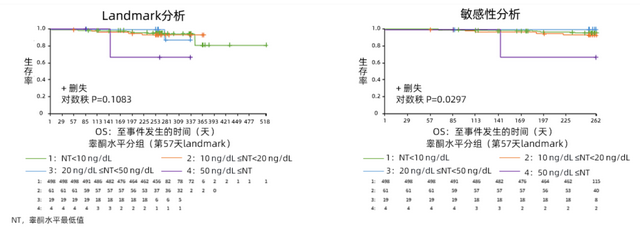
图2. Landmark分析中不同NT组OS的Kaplan-Meier曲线图
DSS结果在主分析中,NT<10 ng/dL组的DSS率高于10 ng/dL≤NT<20 ng/dL组,但可能由于因前列腺癌死亡的患者数相对较少,统计效能不足,因而未能显示统计学意义。而敏感性分析验证了DSS率的差异,且具有统计学意义(图3)。

图3. 不同NT组DSS的Kaplan-Meier曲线图
Landmark分析同样支持上述结果(图4)。

图4. Landmark分析中不同NT组DSS的Kaplan-Meier曲线图
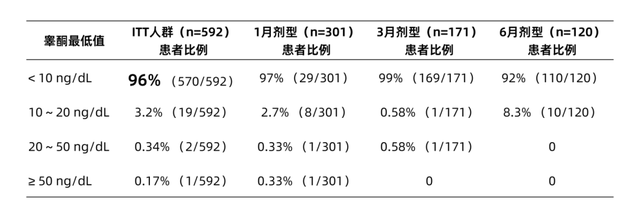
睾酮水平结果在592例患者中,NT达到<10 ng/dL、10~20 ng/dL、20 ng/dL~50 ng/dL和≥50 ng/dL的患者比例分别为96%、3.2%、0.34%和0.17%(表1)。所有患者睾酮水平低于10 ng/dL、20 ng/dL和50 ng/dL的时间比例分别为82%、94%和99%。
表1. 达到不同睾酮水平最低值的患者比例
前列腺癌是中国男性发病率第7位的恶性肿瘤[6]。虽然在过去的十多年中,由于诊疗技术的进步和众多新药的出现,我国前列腺癌患者的5年生存率始终在提高,已从2008-2010年的66.4%提高至2019-2021年的73.9%[7],但同期欧洲发达国家前列腺癌的5年生存率已超过90%,而美国更是高达97%[8]。这样的差距可能由多种因素造成,其中国家层面的PSA筛查可能是最主要的因素之一。欧美国家多年来在国家层面广泛开展PSA早期筛查,并已显示显著降低了前列腺癌死亡率[9]。但中国人口基数庞大,地区发展不平衡,民众观念差异等多种经济和社会因素导致目前尚无国家层面的PSA筛查项目,很多早期无症状的患者无法及时诊断。因此,与欧美国家相比,中国前列腺癌患者初诊时晚期比例更高,新诊断的患者中约2/3为晚期或转移性患者[10],大多数患者由于尿路症状(59.2%)和骨痛(15.0%)就诊[10],疾病负担也相对更高。因此,在我国前列腺癌诊疗现状下,延长患者的生存期,降低疾病特异性死亡率仍然是最重要的治疗目标。近年来,随着药物开发的进步,晚期前列腺癌的治疗格局发生了较大变化,二联甚至三联的联合治疗逐渐成为主流的标准治疗方案,但无论采用何种联合方案,其基础仍然是以促性腺激素释放激素(GnRH)激动剂为主的ADT。因此研究清楚ADT及其治疗目标与OS获益的关系对于临床药物的选择和患者管理至关重要。所以虽然本研究中汇总的试验均在南非进行,但其结果对中国的诊疗实践仍然非常有意义。
早期,由于检测方法的限制,将双侧睾丸切除术后达到的血清睾酮水平,即<50 ng/dL定义为去势标准,直至现在,国内外指南仍以此标准来评估治疗效果以及判定是否进展至去势抵抗性前列腺癌(CRPC)。但随着检测技术的发展,目前的测量方法可测得手术去势后的平均睾酮水平约为15 ng/dL[11]。另一方面,越来越多的证据显示,在达到<50 ng/dL的去势标准后,进一步降睾酮降低至20 ng/dL与更多获益相关。例如,在PR-7研究中,放疗或手术+放疗后生化复发的患者接受ADT治疗的第1年内,睾酮水平<20 ng/dL的患者进展至CRPC的比例最小(图5),前列腺癌特异性死亡风险也最低[12]。
 图5. PR-7研究中睾酮水平与疾病进展的关系
图5. PR-7研究中睾酮水平与疾病进展的关系
又如,在一项纳入222例接受ADT一线治疗的晚期前列腺癌患者的研究中,多变量分析显示,睾酮水平最低值<20 ng/dL是OS的独立预测因素(HR=0.44,P=0.026),Kaplan-Meier分析亦显示不同睾酮水平患者的OS有显著差异(图6)[13]。

图6. 不同睾酮水平患者OS的Kaplan-Meier曲线
综上所述,ADT治疗期间睾酮水平进一步降低至20 ng/dL可延缓疾病进展,延长生存期。而这也引发了新的思考,20 ng/dL是否为最佳的睾酮抑制水平?更低的睾酮水平是否能够带来进一步获益?遗憾的是这方面的研究目前还比较缺乏。一项加拿大单中心回顾性研究显示,在138例接受ADT治疗并采用质谱法测量睾酮水平的前列腺癌患者中评估了能预测至CRPC时间的最佳睾酮截断值为0.27 nmol/L,睾酮≥0.270 nmol/L的患者进展至CRPC的风险较睾酮<0.270 nmol/L的患者显著增加(单因素分析HR:1.717,95% CI:1.160–2.541;多因素分析HR:1.662,95% CI:1.043-2.648)[14]。而本研究将接受曲普瑞林单药治疗的晚期患者按照睾酮水平最低值分为4个组,结果显示NT<10 ng/dL与更佳的OS和DSS相关。这些结果或能为我们未来的研究方向带来一些启示,对于最优的睾酮控制目标仍然需要更多的探索和证据。但同时我们也应认识到,睾酮检测的灵敏度受到检测方法的限制,其中灵敏度最高的质谱法目前临床应用仍有限,因此在探寻和确定睾酮抑制最佳目标的时候应考虑多方面的因素,做到科学和实践的平衡。结合目前的证据和临床实际情况,前列腺癌治疗期间应科学监测睾酮水平,力图将其控制在20ng/dL以下,从而为患者带来更多获益。
我们也注意到,本研究中曲普瑞林单药治疗可使96%的患者达到NT<10 ng/dL,这是一个相当令人满意的结果,而其中1月、3月和6月剂型的效果相当。幸运的是,目前我国已经获批上市了1月、3月、6月不同剂型的GnRH-a类药物,在保证疗效的同时,为医患带来了更多选择,提供了更多便利。在这些药物的帮助下,我们临床医生能够为患者合理选择治疗方案,达到深度降酮的目标,为患者带来生存和生活质量的双重获益。
小结
作为前列腺癌发生、发展过程中的重要激素,睾酮水平与患者预后密不可分,接受ADT治疗的患者应注意监测睾酮水平。尽管目前指南中去势水平的定义是睾酮<50 ng/dL,但越来越多的证据显示,深度降酮(<20 ng/dL)与更好的生存结局相关,或为更理想的治疗目标。如今,1月、3月、6月剂型的GnRH-a均已在我国获批上市,期待其助力更多患者实现长期深度降酮的管理目标,为患者带来更多生存获益。
参考文献
[1] Cornford P., Tilki D., van den Bergh R.C.N., et al. EAU-EANM-ESTRO-ESUR-SIOG Guidelines on Prostate Cancer[EB/OL]. 2024.
[2] National Comprehensive Cancer Network Clinical Guideline. Prostate Cancer [EB/OL].
[3] 中国临床肿瘤学会指南工作委员会. 中国临床肿瘤学会(CSCO)前列腺癌诊疗指南[M]. 北京: 人民卫生出版社, 2024.
[4] KLOTZ L, BREAU R H, COLLINS L L, et al. Maximal testosterone suppression in the management of recurrent and metastatic prostate cancer[J/OL]. Canadian Urological Association Journal, 2017, 11(1-2): 16-23.
[5] KLOTZ L, TAT T. Testosterone nadir and clinical outcomes in patients with advanced prostate cancer: Post hoc analysis of triptorelin pamoate Phase III studies[J/OL]. BJUI compass, 2024, 5(3): 392-402.
[6] 郑荣寿, 陈茹, 韩冰峰, 等. 2022年中国恶性肿瘤流行情况分析 [J] . 中华肿瘤杂志, 2024, 46(3) : 221-231.
[7] Zeng H, Zheng R, Sun K et al. Cancer survival statistics in China 2019–2021: a multicenter, population-based study. J Natl Cancer Cent. 2024 Jun 22.
[8] Siegel R L, Miller K D, Wagle N S, et al. Cancer statistics, 2023[J/OL]. CA: A Cancer Journal for Clinicians, 2023, 73(1): 17-48.
[9] Hugosson J, Roobol MJ, Månsson M, et al. A 16-yr Follow-up of the European Randomized study of Screening for Prostate Cancer. Eur Urol. 2019 Jul;76(1):43-51.
[10]中国临床肿瘤学会(CSCO). 中国晚期前列腺癌诊疗现状蓝皮书[M].
[11] Oefelein MG, Feng A, Scolieri MJ, et al. Reassessment of the definition of castrate levels of testosterone: implications for clinical decision making. Urology, 2000; 56(6):1021- 1024.
[12] Klotz L, et al. Nadir testosterone within first year of androgen-deprivation therapy (ADT) predicts for time to castration-resistant progression: a secondary analysis of the PR-7 trial of intermittent versus continuous ADT. J Clin Oncol. 2015 Apr 1;33(10):1151-6.
[13] Yamamoto S, et al. Testosterone Reduction of≥480 ng/dL Predicts Favorable Prognosis of Japanese Men With Advanced Prostate Cancer Treated With Androgen-Deprivation Therapy. Clin Genitourin Cancer. 2017 Dec;15(6):e1107-e1115.
[14] Beck J, Rouleau M, Lemire F, et al. Mass spectrometry redefines optimal testosterone thresholds in prostate cancer patients undergoing androgen deprivation therapy. Prostate. 2023 May;83(7):670-677.
声明
本视频/资讯/文章是由益普生医学团队编辑/医疗卫生专业人士撰写提供,旨在用于医疗卫生专业人士间的学术交流,不支持以任何形式转发给非医疗卫生专业人士;如有违反,责任自负;转发给其他医疗卫生专业人士时,也请自觉保护知识产权。
本视频/资讯/文章的内容不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议。内容中出现任何药品并非为广告推广目的,医疗卫生专业人士如进行处方,请严格遵照该药品在中国批准使用的说明书。益普生不承担任何相关责任。
DIP-CN-012325 有效期至2025年7月22日
编辑:Nobody
审校:Kristen执行:Gardenia本平台旨在为医疗卫生专业人士传递更多医学信息。本平台发布的内容,不能以任何方式取代专业的医疗指导,也不应被视为诊疗建议。如该等信息被用于了解医学信息以外的目的,本平台不承担相关责任。本平台对发布的内容,并不代表同意其描述和观点。若涉及版权问题,烦请权利人与我们联系,我们将尽快处理。
医脉通是专业的在线医生平台,“感知世界医学脉搏,助力中国临床决策”是平台的使命。医脉通旗下拥有「临床指南」「用药参考」「医学文献王」「医知源」「e研通」「e脉播」等系列产品,全面满足医学工作者临床决策、获取新知及提升科研效率等方面的需求。

