Ⅱ型糖尿病(T2DM)是一组因胰岛素绝对或相对分泌不足和(或)胰岛素利用障碍引起的碳水化合物、蛋白质、脂肪代谢紊乱性疾病,以高血糖为主要标志。
随着时间推移糖尿病会对自身的多种组织器官以及系统带来严重的损害,尤其是眼、肾、心脏、血管、神经等具有慢性损害以及功能障碍。糖尿病已经成为威胁人类生命健康最普遍的一类疾病。
最新研究数据表明:糖尿病的知晓率仅为36.5%,只有32.2%的患者接受诊疗,且接受诊疗的患者中仅有49.2%的患者糖化血红蛋白(HbA1c)得到了有效控制(<7%),这种情况容易导致糖尿病并发症,降低了我国糖尿病诊疗的有效性,同时,巨大医疗费用也给国民经济带来了压力,有效控制糖尿病已成为一件刻不容缓的任务。

现阶段,糖尿病的治疗通常包括口服和注射抗糖尿病药物, 可以减轻高血糖症或暂时改善目标组织中的胰岛素敏感性, 但它们既不能逆转胰岛素抵抗,也不能逆转进展性和必然性的β细胞功能障碍,因此,需探索新的策略以实现最佳的血糖控制。
近年来,随着干细胞研究的不断深入,尤其是间充质干细胞(MSC),因具有取材方便、多向分化和自我更新等特点,被部分研究者用于Ⅱ型糖尿病的临床治疗,干细胞移植可以改善血糖控制和β细胞功能,为治愈Ⅱ型糖尿病带来了希望。
脐带间充质干细胞最新研究
最新研究显示:干细胞是治疗Ⅱ型糖尿病的潜在治疗方法
2023年,解放军总医院母义明教授等人评估了脐带来源间充质干细胞治疗Ⅱ型糖尿病的疗效,并将研究结果发表在《干细胞转化医学》上。

糖化血红蛋白(HbA1c)是评估糖尿病患者血糖控制水平的重要指标。但随着技术的发展,TIR(Time in Range,葡萄糖目标范围内时间)等新指标近年来逐渐受到重视。因为它能提供对血糖控制的全面视角,与糖尿病并发症的风险有关,并能提高患者的生活质量。随着连续葡萄糖监测技术的进步,TIR的测量更为简便,为医生和患者提供了更好的治疗决策依据。
为了进一步评估脐带间充质干细胞对TIR的治疗效果,解放军总医院团队开展了一项II期临床研究,通过回顾性连续血糖监测(CGM),调查评估了中国成年Ⅱ型糖尿病患者中,脐带间充质干细胞输注的疗效。
在这个随机安慰剂对照的试验中,共有 73 名患者被分配接受脐带间充质干细胞(n=37)或安慰剂(n=36)的静脉输注,每 4 周输注一次,一共注射 3 次,并随访 48 周。在主要终点评估TIR(葡萄糖目标范围内时间)和糖化血红蛋白(HbA1c)的变化。
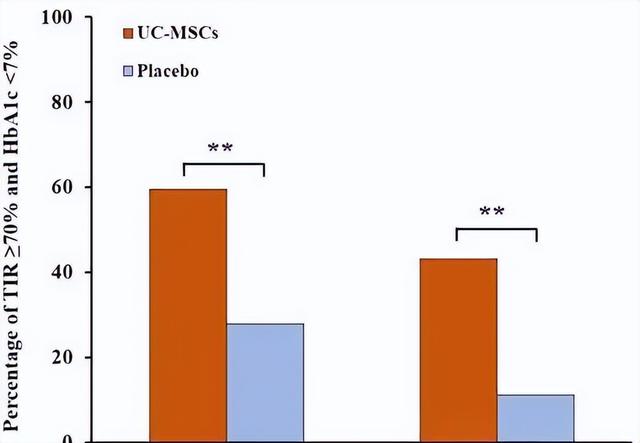
与基线相比,治疗 48 周后,脐带组和安慰剂组的TIR和HbA1c均显著改善。与安慰剂组相比,脐带组在 9 周和 48 周时TIR和HbA1c的变化更明显。脐带组中更多的患者在 9 周和 48 周达到了TIR≥70%和HbA1c<7%的血糖控制目标。
为了更好地理解脐带间充质干细胞对Ⅱ型糖尿病的影响,研究人员进一步探讨了影响因素。数据显示,通过静脉输注的干细胞显著增加了TIR,而如果男性患者OGTT试验C肽曲线下面积(AUCC-Pep)较高,更有可能从干细胞治疗中受益。

结果表明,通过静脉输注脐带间充质干细胞是改善Ⅱ型糖尿病的有效方法。
MSCs改善Ⅱ型糖尿病的安全性和有效性
2023 年 3 月,一篇发表在《糖尿病、代谢综合征和肥胖》杂志上的一篇综述,对间充质干细胞(MSCs)治疗人Ⅱ型糖尿病(T2D)的安全性和有效性进行了评价。
研究人员从58项试验中筛选出6项符合纳入标准的试验进行研究,对262例患者进行间充质干细胞治疗的结果进行了分析。
经过12个月的随访分析,间充质干细胞治疗减少了抗糖尿病药物的剂量。间充质干细胞有效治疗剂量范围为1×106 cells/kg ~ 3.7×106 cells/kg。治疗后,HbAc1水平平均降低32%,空腹血糖水平平均降低45%。
2个试验的C肽水平平均下降38%,4个试验的C肽水平平均上升36%。所有试验均未发现严重不良事件。
由此得出结论:MSC治疗Ⅱ型糖尿病是安全有效的。但仍需进行更深入的基础研究与更大规模的临床治疗以建立干细胞标准化生产流程,如干细胞治疗的最佳细胞输送途径、给药剂量、给药间隔、给药频率、应用年龄节点等,进一步推动这种疗法的临床应用,最终让更多的患者受益。
参考文献:
[1]Li Zang, Yijun Li, Haojie Hao, Jiejie Liu, Qian Zhang, Fei Gao, Haibin Wang, Yulong Chen, Weijun Gu, Jin Du, Junhua Meng, Saichun Zhang, Zhaohui Lyu, Jingtao Dou, Yiming Mu, Efficacy of Umbilical Cord-Derived Mesenchymal Stem Cells in the Treatment of Type 2 Diabetes Assessed by Retrospective Continuous Glucose Monitoring, Stem Cells Translational Medicine, Volume 12, Issue 12, December 2023, Pages 775–782, https://doi.org/10.1093/stcltm/szad060.
[2]Mikłosz, A, Chabowski, A. Efficacy of adipose-derived mesenchymal stem cell therapy in the treatment of chronic micro- and macrovascular complications of diabetes. Diabetes Obes Metab. 2023; 1-16. doi:10.1111/dom.15375
