仅供医学专业人士阅读参考
点击右上方“关注”,准时接收每日精彩内容推送。
慢性胰腺炎(CP)是一种以胰腺腺泡组织进行性炎症为特征的疾病。这种炎症的病因多种多样,包括吸烟、饮酒、胆结石和遗传变异等。患有CP的患者常遭受慢性腹痛的折磨,这通常导致住院和残疾。随着炎症的持续,胰腺组织被破坏,凋亡的腺泡细胞增加了10倍,产生胰岛素的β细胞质量减少了29%。目前还没有全面治疗此病的方法。管理措施包括生活方式的改变、优化疼痛药物和营养。当药物治疗不再有效时,外科干预成为缓解疼痛的最后手段。全胰切除术后门静脉内自体胰岛移植(TP-IAT)治疗CP的临床效果不佳,原因是胰腺炎症、胰岛分离过程中的氧化应激以及肝脏血管中恶劣的植入条件。
来自美国西北大学的Guillermo A. Ameer团队开发了一种温度响应性抗氧化大分子PPCN,用以保护胰岛的氧化还原状态和功能,并实现在肝外网膜中的胰岛植入。PPCN溶液在体温下从液体转变为水凝胶。被PPCN包裹并暴露于氧化应激下的胰岛保持功能,并支持长期正常血糖,与被血浆-凝血酶生物支架包裹的胰岛形成对比。在非人灵长类动物(NHP)的网膜中,PPCN耐受性良好,植入后3个月大部分被吸收且无纤维化。在NHP中,使用PPCN的自体网膜胰岛移植恢复了正常血糖,且100多天内对外源性胰岛素的需求最小。这项临床前研究支持在CP患者中使用PPCN进行TP-IAT,并强调了抗氧化性质作为保护胰岛功能的机制。相关工作以题为“Phase-changing citrate macromolecule combats oxidative pancreatic islet damage, enables islet engraftment and function in the omentum”的文章发表在2024年06月07日的期刊《Science Advances》。

1.创新型研究内容
本文假设一种具有抗氧化、水溶性和可降解的大分子在体温诱导的相变下能够(i)便于胰岛的轻松包裹和运输到网膜,(ii)使得胰岛在送达后能够在目标组织上定位和植入,并且(iii)显著抵消胰岛在经历胰腺炎、酶分离和移植后氧化应激的负面影响(图1A)。PPCN是一种含柠檬酸的大分子,具有较低的LCST,允许其在生理体温下从液体转变为凝胶,并且具有内在的抗氧化特性,能够减轻对组织的氧化损伤。本文报告了PPCN在体外培养过程中以及体内移植到小鼠脂肪垫后,保护小鼠和人类胰岛免受氧化应激引起的损伤。还展示了将PPCN应用于非人灵长类动物(NHPs)的网膜是安全的,并且不会引发有害的异物反应,因为这种水凝胶是可生物吸收的。最后,本文证明了PPCN可以在NHP模型中支持IAT超过100天,导致胰岛血管化和最小化的外源性胰岛素需求。由于氧化应激在胰腺炎的发病机制中扮演关键角色,能够减轻氧化应激的药剂应该能改善胰岛移植的结果。
【PPCN具有抗炎作用,维持胰岛活性,并在培养中支持胰岛素的分泌】
PPCN通过两步法合成制备,首先进行缩聚反应,包括柠檬酸、聚乙二醇(PEG)和甘油1,3-二甘油二丙烯酸酯,然后与N-异丙基丙烯酰胺(NIPAAm)进行自由基聚合(图1B)。PPCN溶解在磷酸盐缓冲盐水(PBS)中,在28℃的低临界溶液温度(LCST)下表现出可逆的液态到固态相变,这比均聚物聚(N-异丙基丙烯酰胺)(pNIPAAm)的LCST(32℃)要低(图1B到D)。合成质量通过质子核磁共振(HNMR)、傅里叶变换红外光谱(FTIR)和流变学(图1D)得到了确认。上述LCST使得PPCN能够在室温下(~25℃)轻松作为液体应用到体内的目标组织并伴随胰岛,并通过在37℃下的凝胶化促进胰岛在这些位置的包裹(图1A,C和D)。

图1 PPCN的温度响应性和抗氧化特性适合用于胰岛保存
为了评估PPCN对胰岛功能的影响,分别在标准悬浮培养和包裹在BS、PPCN或pNIPAAm中后,对小鼠(图2A,C和E)和人类(图2B,D和F)胰岛的活性和胰岛素分泌能力进行了体外评估。新分离的胰岛要么在组织培养塑料上培养,要么与自体BS、PPCN或pNIPAAm溶液在室温下混合。通过向BS中添加凝血酶或在37℃下孵育胰岛-PPCN或胰岛-pNIPAAm混合物,胰岛被成功包裹在每种水凝胶中。使用刃天青试验随时间监测包裹的胰岛的活性(图2)。对于小鼠(图2A)和人类(图2B)胰岛,除了pNIPAAm处理组外,48小时的体外培养中活性都得以保持。两个物种的胰岛在包裹在pNIPAAm中时,在24小时活性损失了40%,在48小时损失了60%(图2A和B)。

图2 PPCN有助于在体外保存小鼠和人类胰岛的活性与胰岛素分泌功能
【PPCN保护胰岛免受诱导的氧化应激,从而在培养期间保持其功能】
为了在体外模拟与CP相关的胰岛氧化损伤,本文将10μM的过氧化氢(H2O2)加入到前文中提到的每个胰岛培养环境中。选择这个H2O2浓度是为了模拟实验性胰腺炎模型中由腺泡细胞产生的生理性H2O2浓度。使用共聚焦显微镜成像监测小鼠和人胰岛氧化损伤的进展(图3A和B)。在计时开始时,即引入H2O2之前,所有四组胰岛都观察到一个主导的488 nm信号(还原形式显示为绿色),小鼠胰岛的基线平均氧化百分比为13%,人类胰岛为10%(图3A到D)。引入H2O2后5分钟,测量到小鼠胰岛在对照组介质悬浮培养、BS、pNIPAAm和PPCN中的氧化分别增加了27.0、23.1、20.6和14.6%。在30分钟时,培养在介质悬浮液(36.5%)、BS(30.4%)和pNIPAAm(30.4%)中的胰岛氧化显著增加,而包裹在PPCN中的胰岛氧化增加到19.7%。在12小时时,PPCN组观察到44%的氧化,而在其余组中观察到大约80%的氧化。人类胰岛也观察到了类似的趋势(图3B和D);然而,总体而言,人类胰岛似乎对氧化更具抵抗力。

图3 PPCN保护小鼠和人类胰岛免受体外诱导的生理性氧化应激水平的损害
【PPCN是一种多功能胰岛输送载体,可在体内保护胰岛功能】
为了评估PPCN是否可以用来将胰岛输送到肝外部位,使用小鼠的腹部脂肪垫来模拟人类中将胰岛移植到网膜的过程。选择这个模型是因为这两种结构都是位于腹腔内的富含血管的脂肪组织。选择同种系C57BL/6到C57BL/6小鼠模型是为了模拟自体胰岛移植,并避免与异体移植相关的复杂免疫反应。胰岛移植程序的关键步骤总结在图4A中。当应用到脂肪垫上时,PPCN在与组织接触后的几秒钟内完全凝胶化,将所有胰岛固定在脂肪垫上。由于PPCN的组织粘合性,这一步不需要缝合或组织胶水。整个过程在5分钟内完成。相比之下,BS通过凝血酶交联反应需要更长时间才能固化,这使得控制胰岛的最终位置变得困难。研究中还包括了额外的对照组。将胰岛移植到肾囊(KC)作为一个阳性对照,因为它被广泛用作小动物中的肝外胰岛移植位置。然而,由于解剖学差异,KC移植在人类中并不进行。此外,本文还使用了门静脉内胰岛移植作为另一个阳性对照,因为这是临床中使用的移植部位。然而,在这个部位,不可能在保持动物存活的同时取回移植的胰岛,以确保血糖(BG)的任何变化都是由移植的胰岛引起的,而不是残留的胰腺功能。
糖尿病的发生率被定义为连续(两次或以上)血糖测量值大于200 mg/dl。当以每公斤体重(BW)移植8200胰岛当量(IEQ)时,所有三组的动物在移植手术的第二天都达到了正常血糖水平(图4B和C)。所有四组动物的正常血糖水平一直保持到移植后第104天,此时进行了第二次存活手术,以移除移植的胰岛移植物,确认胰岛素产生的来源(除了门静脉内组外)。手术后恢复期间,在所有动物中都检测到了高血糖,证实了研究过程中维持正常血糖水平是由包含在脂肪垫(或肾囊)中的胰岛负责的(图4B)。

图4 PPCN将胰岛定位到目标移植部位,并以较少的胰岛质量恢复正常血糖水平
【PPCN减少炎症,减轻DNA氧化损伤,并支持移植胰岛的新血管化】
本文对移植的胰岛进行了组织学和免疫荧光染色(脂肪垫和肾囊),使用MT和H&E染色来评估胶原蛋白的产生和胰岛移植物的形态(图5A)。针对胰岛素和α-SMA的抗体探针确认了胰岛素的产生,完整胰岛结构的存在以及移植胰岛内的新生血管化(图5A)。BS和PPCN都被完全吸收,留下被原生脂肪组织包围的胰岛。在移植部位的MT染色切片中观察到很少的胶原纤维和炎症细胞,表明缺乏BS或PPCN引起的慢性异物反应。由于PPCN导致的有利胰岛移植由相对于使用BS移植的胰岛更大的胰岛大小支持,如通过H&E染色定量(图5A和B)。根据α-SMA染色,使用PPCN移植的胰岛中的血管化程度显著(P < 0.05)高于使用BS的胰岛(图5A和C)。因为之前有报道称增加的氧化应激与胰腺炎相关的胰岛损伤密切相关,所以进行了8-OHdG标记物的共染色,以评估胰岛移植物中的氧化诱导DNA损伤(图5A)。在使用BS移植到脂肪垫的胰岛中,8-OHdG的表达显著更高,而在用PPCN移植的胰岛中没有观察到信号(图5D)。尽管在KC组也观察到许多8-OHdG阳性细胞,但与BS组不同,KC组中的大多数8-OHdG阳性细胞存在于原生肾脏组织中而不是移植的胰岛中(图5A)。

图5 PPCN保护移植的胰岛免受体内氧化诱导的DNA损伤
【PPCN在应用于NHPs的大网膜时,具有良好的耐受性,不会引发有害的异物反应,并且会被吸收】
与小型啮齿动物的腹部脂肪垫不同,大动物如NHPs和人类的大网膜因其良好的血管结构和血管生成特性,是腹腔内疾病病理生理学的一种自然防御机制。人类大网膜中的促炎环境可能会影响胰岛功能;因此,支架材料与这种组织的兼容性至关重要。由于人类和NHPs在胰岛结构和功能以及大网膜的大小和解剖结构上的相似性,促使本文研究PPCN在NHPs中的组织反应,特别是恒河猴的组织反应。通过剖腹手术将PPCN应用于大网膜的过程如图6A所示。PPCN可以很容易地通过注射器作为液体应用,并在接触组织时在体温下迅速转变为不透明的水凝胶,仅需几秒钟。移植物被固定并被周围的大网膜组织覆盖,无需缝合或钉合。在整个3个月的研究过程中,本文仔细监测了动物的健康状况,包括性情、体重、全血细胞计数(CBC)和生化指标。体重保持稳定或增加(图6B)。通过血液尿素氮(BUN)和肌酐浓度评估的肾脏健康显示功能没有持续受损(图6C和D)。同样,通过胆红素和天门冬氨酸氨基转移酶(AST)测量的肝功能在整个研究期间得到维持(图6E和F)。在植入后大约3个月时,通过手术访问并检查植入部位是否有炎症或对PPCN的异物反应(图6A,左侧移植)。通过腹腔镜内部检查植入物表现正常。在所有动物中,观察到少量白色物质似乎是剩余的PPCN(约最初应用材料的20%)。整个大网膜从体腔中拉出进行肉眼检查(图6A,中间移植)。没有发现异物反应的迹象。整个大网膜被取出进行组织病理学检查。组织病理学报告确认除了少数显示有剩余PPCN迹象的区域外,没有炎症、纤维化或组织异常。包括血管化在内的组织组成也表现正常(图6A,右侧移植)。总的来说,当PPCN应用于大网膜时,大型NHPs能够很好地耐受,因为动物在整个研究中保持了他们的基线健康,行为、血液参数或大网膜炎症没有变化。

图6 PPCN与非人类的灵长类动物的网膜生物相容
【PPCN使得在将自体胰岛移植到NHPs的大网膜后,胰岛能够发挥功能】
为了在NHP模型中模拟使用TP-IAT治疗CP(图7A),首先进行了远端胰腺切除术,随后使用STZ化学诱导糖尿病。分离的胰岛经过过夜培养并染色以评估形态、活性和纯度。RH9139的活性为75±32%,RH9144为93±15%。两只动物的纯度都超过了95%。进行了GSIS测定。刺激指数分别为RH9139的1.0±0.1和RH9144的2.5±0.5。移植的胰岛剂量为RH9139的39473 IEQ和49638 IPN(6,073 IEQ/kg)以及RH9144的68685 IEQ和61811 IPN(7717 IEQ/kg)。对剩余胰腺组织的H&E染色在尸检时确认了缺乏原生内源性胰岛。胰腺切除术后的第二天,通过剖腹手术在大网膜上进行了自体胰岛移植,使用了大约4 ml的PPCN(图7A)。NHPs被密切监测了100多天。在整个研究过程中,仔细监测了动物的健康状况,包括性情、体重、血液化学和血糖。体重保持稳定或增加(图7B)。通过BUN和肌酐浓度评估的肾脏健康显示功能没有持续受损(图7C和D)。同样,通过胆红素和AST测量的肝功能在整个研究期间得到维持(图7E和F)。本文监测了血糖(图7G,左轴),并根据需要给予了胰岛素格拉尔金(图7G,右轴)。对于RH9139,移植后的第一个月,血糖维持在186 mg/dl(平均值),每天平均给予5.1 U胰岛素。1个月后,平均血糖降至123 mg/dl(平均值),外源性胰岛素需求降至每天2.8 U(平均值)。对于RH9144,移植后的第一个月,血糖平均值为190 mg/dl,平均给予5.2 U胰岛素。1个月后,平均血糖降至134 mg/dl(平均值),外源性胰岛素需求降至每天3 U(平均值)。在研究的整个过程中,两只动物都能检测到C-肽。在生存大网膜切除术后,不再能检测到C-肽,确认C-肽的分泌是由于移植到大网膜上的自体胰岛,而不是由于胰腺切除术后和STZ给药后剩余的原生内源性胰岛(图7H)。在取出时,两只动物的大网膜内都发现了功能性的产胰岛素胰岛(图7I)。
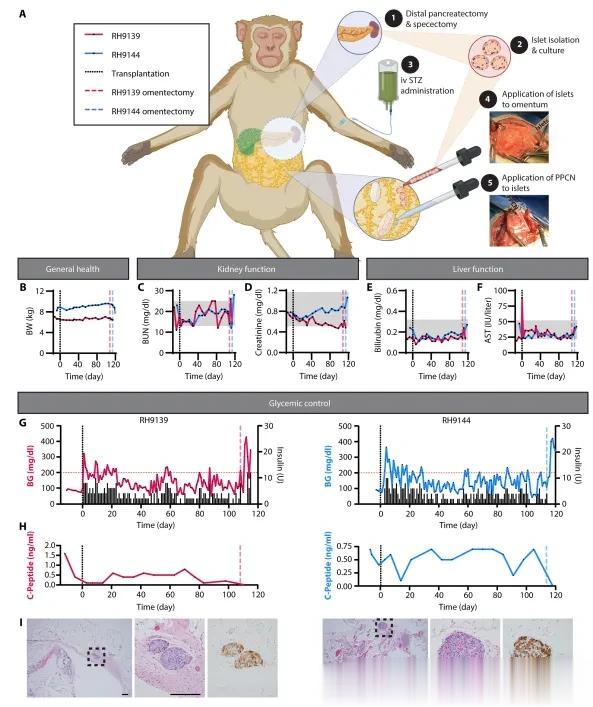
图7 PPCN使得在非人灵长类动物模型中进行自体网膜胰岛移植成为可能
2.总结与展望
尽管本文已经证明了PPCN作为CP患者附加治疗工具的转化潜力,但本文的研究存在一些局限性。本文的动物模型关注CP对胰岛的影响,并未反映CP患者在多年患病后所经历的全身性炎症。通常,CP患者的血液中炎症细胞因子水平升高,包括IL-1β、IL-6、IL-8、IFN-γ、巨噬细胞抑制细胞因子、中性粒细胞明胶酶相关配体、TGF-β和TNF-α。这种炎症可能对胰岛移植有影响,并可能对CP患者经历的TP-IAT的负面结果有所贡献。未来的工作还应关注开发可用于测试CP疗法的临床相关方法的CP模型。可以考虑使用一个体外模型,通过提高细胞因子浓度来模拟CP患者的情况。对于体内工作,重要的考虑因素包括使用直立动物以及化学或手术诱导CP,准确模拟胰腺炎症、胰岛损失和全身性炎症。此外,必须考虑到当前TP-IAT的外科难度。在临床环境中,胰腺切除术、胰岛分离和门静脉内输注都在同一天的几个小时内完成。胰岛经过最小程度的纯化并与腺泡组织一起输注。对于此处介绍的NHP模型,由于需要给予STZ来建立TP,需要一个过夜的洗出期以确保STZ不会损害移植的胰岛。因此,部分胰腺切除术、胰岛分离和STZ治疗在第一天进行,而移植则在第二天进行。分离后,胰岛被完全纯化,去除了腺泡组织,然后培养过夜。可能需要修改NHP模型或临床实践以确保一致性。为促进PPCN在TP-IAT中的临床应用,应使用相同的胰岛剂量和临床标准,在NHP中进行一项比较门静脉胰岛输送和PPCN介导的大网膜胰岛移植的头对头研究。鉴于本文在小鼠和NHP中得到的结果,这些结果显示使用PPCN可以改善胰岛移植结果,以及门静脉胰岛输送的实际和生物学挑战,如肝血栓形成和IBMIRs,相变抗氧化生物材料如PPCN可以在胰岛功能保存、肝外移植和提高CP患者的生活质量方面发挥重要作用。
了解更多
关注“EngineeringForLife”,了解更多前沿科研资讯
