
编者按:恶性黑素瘤是容易转移、恶性程度较高的一种皮肤肿瘤。近年来,人们对恶性黑素瘤的认识逐渐提高,同时免疫治疗、靶向治疗等新治疗手段的不断增加,中国黑色素瘤的诊疗规范化逐步完善,预后有明显提升,但仍存在早期诊断率低,治疗手段滞后,患者预后差等问题。
本期「专家组稿」由河北医科大学第四医院崔彦之教授担任执行主编,与巴州人民医院戚锐锋教授、王浩医生共同分享NRAS突变型肢端黑色素瘤多线治疗的病例报道,为医者和患者提供更多参考。
专家介绍

崔彦芝
河北医科大学第四医院肿瘤内科副主任
医学博士,主任医师、副教授,硕士研究生导师
CSCO免疫治疗专家委员会委员
中国抗癌协会原发灶不明和多原发肿瘤专业委员会委员
中国抗癌协会肿瘤微环境专业委员会委员
河北省抗癌协会肿瘤转移专业委员会秘书
河北省肿瘤防治联合会肿瘤免疫治疗专委会副主委
河北省健康学会肿瘤免疫微环境管理及临床转化应用分会副主委
河北省抗癌协会多原发和不明原发肿瘤专业委员会常委
河北省抗癌协会肿瘤多学科诊疗专业委员会常委
河北省预防医学会乳腺癌防治专业委员会 常委
河北省女医师协会免疫治疗、热疗专委会 常委

戚锐锋
巴州人民医院肿瘤内科副主任、主任医师
中国医药教育协会肺部肿瘤专委会委员
北京肿瘤防治研究会转化医学分委会委员
新疆抗癌协会化疗及生物靶向治疗专委会委员
新疆抗癌协会肺癌专业委员会委员
新疆抗癌协会整合肿瘤心脏病学专委会委员
新疆抗癌协会第二届乳腺癌专业委员会委员
自治区卫生健康委癌痛规范化诊疗专家委员会委员
新疆巴州肿瘤专业质量控制中心主任
新疆巴州疼痛专业质量控制中心副主任
巴州劳动能力鉴定委员会专家

王浩
巴州人民医院肿瘤内科主治医生
题目:NRAS突变型恶性黑色素瘤多线治疗个案分析
◾ 作者:崔彦芝 戚锐锋 王浩
基本情况:患者女性,56岁,汉族,于2015-11-12行右足底浅表肿物切除术。
术后病理:(右足)皮肤恶性黑色素瘤,肿瘤浸润深度0.4cm一侧切缘皮肤见肿瘤组织,肿瘤距足底最近切缘小于0.1mm。
诊断:右足底恶性黑色素瘤。
2015-12-02行右足底皮肤病损切除术(皮肤黑色素瘤扩大切除术)+取皮植皮术,
术后病理示:(右足底黑色素瘤扩切标本)病变符合恶性黑色素瘤,肿瘤侵及皮下组织,肿瘤最大径3.5cm,趾侧、足跟、外侧、内侧切缘及基底未见肿瘤组织。术后给予干扰素a-2b *11个月。
2018-01发现右侧右侧腹股沟区肿大淋巴结,2018-01-15行“右侧腹股淋巴结快速冰冻活检+右侧腹股沟淋巴结清扫术”;
术后病理提示:(右侧腹股沟淋巴结)可见肿瘤转移(1/1)。原手术残腔、皮肤及基底切缘未见肿瘤组织,未见明确淋巴结结构;另送(柯氏淋巴结)淋巴结未见肿瘤转移(0/1)。
2018-03-06开始右侧腹股沟强调放疗,同时应用重组人干扰素α-2b*8个月。2018-11停药。
停药后半年右侧腹股沟区出现多个肿块,蔓延至右腿,未诊疗,肿块长期破溃不愈。
2022-01-08右侧大腿浅表肿物切检病理:(右下肢)梭形细胞肿瘤,基底未见病变残留,近切缘可见病变残留。免疫组化:CD34(-),CK(Pan)(-),Desmin(-),HMB45(+),ki-67指数约(5%),SMA(-),SOX10(+),Vimentin(+)。支持恶性黑色素瘤,诊断:(右下肢)皮下转移性恶性黑色素瘤。
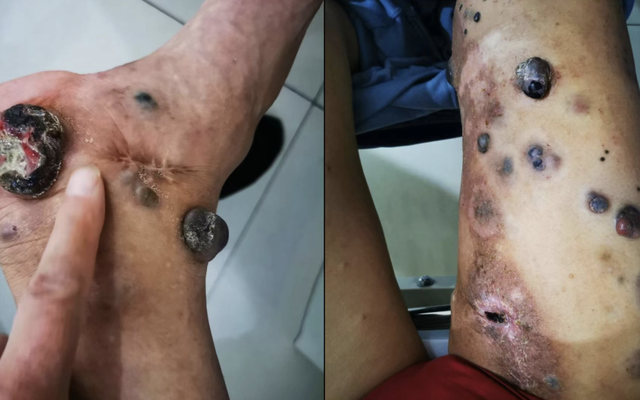
左右滑动查看病例
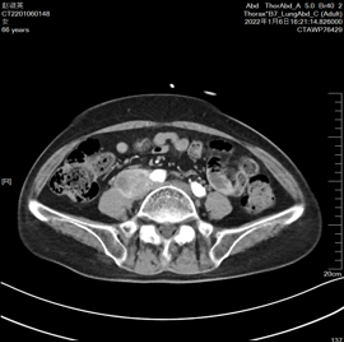

2022-01肿瘤供血动脉栓塞,开始特瑞普利单抗*12次,后当地治疗。

2022-04-12

2022-07-21(SD)
2022-12 CT提示病情缓慢进展,疗效评价SD。继续:特瑞普利单抗。
完善基因检测:NRAS p.Q61K(30.8%)突变;BRAF V600突变阴性

2022-12(病情缓慢进展)
2023-05 CT 提示腹膜后、双侧髂血管旁及左侧腹股沟区多发肿大淋巴结、部分融合,较前明显增多、增大,右侧股骨近端层面皮下多发转移灶,较前增大。评价PD。

2023-05

2023-08
二线:靶向+免疫:仑伐替尼+特瑞普利单抗。2023-08CT提示淋巴结转移灶较前缩,但出现药物性心功能不全(射血分数67%降至47%)。调整方案为:特瑞普利单抗+贝伐珠单抗。

左右滑动查看病例

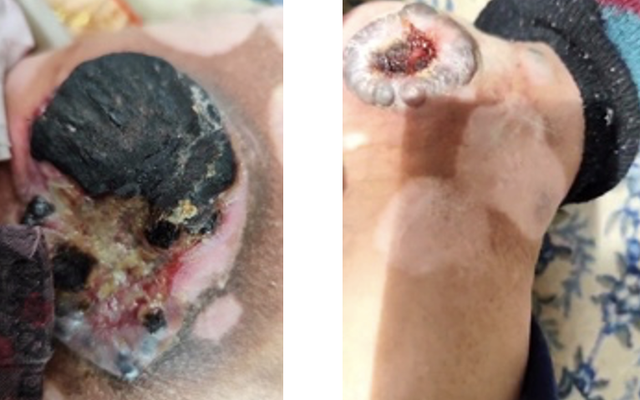
2023-11-06(PD,增大,出现新发病灶)
2023-11-06复查CT,腹腔淋巴结、左侧腹股沟区病变增大,外阴新发病灶。下肢肿胀加重。
于2023-11-10 免疫+化疗:特瑞普利单抗+达卡巴嗪 *4周期。

左右滑动查看病例
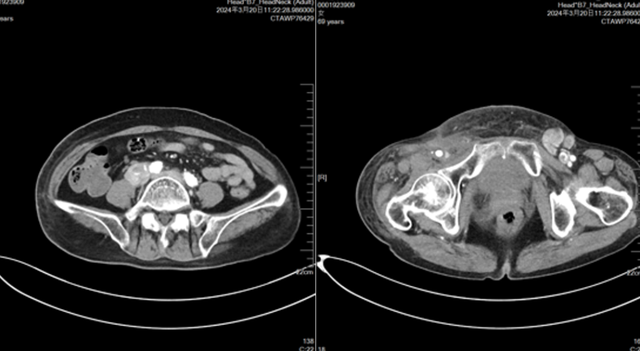
2024-03-30(评估病情进展,下肢病灶增大,腹腔淋巴结增大,下肢肿胀加重)
左右滑动查看病例
2024-04-01调整治疗方案:特瑞普利单抗+替莫唑胺+阿帕替尼;(建议妥拉美替尼)
讨论
1、本例患者为肢端黑色素瘤
肢端型黑色素瘤和黏膜型黑色素瘤是亚洲常见的亚型,中国的黑色素瘤中一半是肢端型,1/4是黏膜型,而美国的肢端加黏膜型黑色素瘤占总体的比例还不到5%,东西方患者特征与预后也存在多方面的差异。早期黑色素瘤的活检有局部活检及全切活检,一般建议全切活检。治疗涉及到手术、放射治疗、药物治疗等多方面,诊治必须重视多学科诊疗团队的模式,根据分期制定相应治疗策略。手术是治疗的基石,国内已经发布《皮肤及肢端恶性黑色素瘤外科诊治中国专家共识》[1],通过规范外科切除让患者获益最大化。对于复发风险较高的黑色素瘤患者,需要术后辅助治疗,来降低患者复发转移风险。术后分期主要根据原发灶肿瘤浸润的厚度、区域淋巴结转移的状态,是否存在远处转移三个方面。分期对后续治疗至关重要,不同分期,术后辅助治疗策略不同。I期患者推荐临床实验或观察。II期患者,尤其是IIb和IIc期的患者预后较差,需要有效的辅助治疗策略;过去一般采用大剂量的干扰素进行术后辅助治疗,目前可以建议患者进行观察或者参加临床试验。我国肢端黑色素瘤相对较多,这类肿瘤的肿瘤浸润淋巴细胞水平相对低,对免疫治疗的反应率可能会比较差,因此,肢端黑色素瘤的辅助治疗大剂量干扰素仍为推荐方案,PD-1单抗缺乏大规模循证医学证据。同时分子诊断也非常重要,诸如BRAF、c-KIT和NRAS等基因突变检测,将为后续治疗方案的制定奠定基础。晚期患者最初借助化疗、细胞因子治疗等手段,如今免疫、靶向等治疗药物陆续研发上市,治疗格局出现了翻天覆地的变化。常用的治疗药物包括大剂量干扰素α2b 治疗,BRAF 抑制剂±MEK 抑制剂(BRAF 突变)、PD-1单抗、CTLA4单抗等。
2、本患者为NRAS突变型肢端黑色素瘤
众所周知,黑色素瘤的发生、发展与多种癌基因激活密切相关。15%~20%的患者存在NRAS基因激活突变,多发生于第61位密码子,以Q61R为主,侵袭性强,治疗难度大。针对NRAS突变的晚期黑色素瘤患者的治疗,目前NCCN指南一线推荐是免疫治疗,二线如果患者检测出NRAS突变,则推荐MEK抑制剂比美替尼,推荐理由主要基于比美替尼在NRAS突变的一项III期关键研究,相比达卡巴嗪,比美替尼能获得更长的PFS,分别是2.8个月 vs 1.5个月,P<0.001; 而OS没有明显获益,分别是11.0个月vs10.1个月,P=0.05。因中西方人群种群差异,中国患者对免疫治疗的应答不佳, ORR仅为6.1%,因此与西方不同,中国CSCO黑色素瘤诊疗指南一线推荐化疗,免疫治疗或者化疗联合免疫治疗,二线如果有NRAS突变的患者,将妥拉美替尼(HL085)纳入I级推荐。
近年来,在NRAS突变亚型中靶向治疗方案的探索主要集中在NRAS下游丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)通路,但结果不一;新型MEK1/2抑制剂妥拉美替尼(tunlametinib),在晚期NRAS突变患者中总体客观缓解率(objective response rate,ORR)达到34.7%,较既往的binimetinib显著提高[2];其中,既往接受过免疫治疗患者的ORR达39.1%;中位PFS为4.2个月,DCR为72.6%,1年OS率为57.2%。在安全性方面,最常见的≥3级TRAE包括血肌酸激酶升高、腹泻、水肿等,耐受性良好,未发现新的安全性信号。2024年3月15日,妥拉美替尼获得中国国家药品监督管理局(NMPA)的附条件批准,用于治疗含抗PD-1/PD-L1治疗失败的NRAS突变的晚期黑色素瘤患者。据新闻稿,这是目前首个获批NRAS突变晚期黑色素瘤适应证的MEK抑制剂。其他单药靶向治疗及联合治疗策略正在探索中,总之,目前针对NRAS突变型黑色素瘤的靶向和免疫治疗方案均未能媲美BRAF抑制剂在BRAF突变型病例中达到的治疗反应率,但近年来基于MEK抑制剂的部分联合治疗策略已经取得喜人的进展[3]。本患者后续有条件拟行妥拉美替尼治疗。
点评
准确的分期对黑色素瘤的预后和治疗至关重要。指南基于AJCC分期给予了相应的治疗推荐,规范的病理报告对于黑色素瘤规范化治疗非常重要,并强调了微卫星灶及SLNB对疾病分期的价值。早期黑色素瘤确诊后应尽快进行手术切除。术前新辅助和术后辅助治疗可降低患者术后复发风险。晚期黑色素瘤治疗手段包括辅助化疗、干扰素治疗、靶向治疗和免疫治疗。中国以肢端和黏膜型黑色素瘤为主,这类患者对免疫治疗反应的敏感性较差,这一现状给予了我们巨大的挑战。《2021 CSCO黑色素瘤诊疗指南》建议所有的黑色素瘤患者在治疗前都要进行基因检测,包括BRAF、c-KIT和NRAS,进行分子分型。依靠分子诊断的个体化靶向药物包括但不仅限于C-kit抑制剂、BRAF抑制剂、MEK抑制剂等,给携带这些特定基因突变的患者带来了新的治疗方案选择。分子检测、药物可及性及经济负担限制了这些药物的应用,随着医保及分子检测的普及,将迎来黑色素瘤治疗的新篇章。
参考文献:
1.皮肤和肢端恶性黑色素瘤的外科治疗规范中国专家共识,[J]中华肿瘤杂志, 2020,42(02) : 81-93.
2.DUMMER R, SCHADENDORF D, ASCIERTO P A, et al. Binimetinib versus dacarbazine in patients with advanced NRAS-mutant melanoma (NEMO): a multicentre, open-label, randomised, phase 3 trial[J]. Lancet Oncol, 2017, 18(4):435-445.
3.MAO L, GUO J, ZHU L, et al. A first-in-human, phase 1a dose-escalation study of the selective MEK1/2 inhibitor FCN-159 in patients with advanced NRAS-mutant melanoma[J]. Eur J Cancer, 2022, 175: 125-135.

版权声明
本文版权归医悦汇所有。欢迎转发分享,其他任何媒体如需转载或引用本网版权所有内容,须获得授权,且在醒目位置处注明“转自:医悦汇”。

