研究背景
近年来,药物分子中的芳香基团逐渐被富含C(sp³)的等构模仿物所替代,如双环[n.1.1]烷,这一变化显著改变了药物的理化性质和药代动力学特性,通常会提高临床成功率。然而,与苯环相比,异芳香环的C(sp³)富含等构模仿物的结构相对稀缺,限制了其在药物开发中的应用。异双环[n.1.1]烷作为一种有前景的替代物,尽管其潜力巨大,但缺乏模块化合成方法的局限性,限制了其深入研究。
成果简介
为了解决这一问题,德国明斯特大学Frank Glorius院士团队设想通过战略性和选择性地将不同的杂原子单元插入到双环[1.1.0]丁烷中,以提供一种高度模块化的平台,进而获取多样化的异双环[n.1.1]烷。
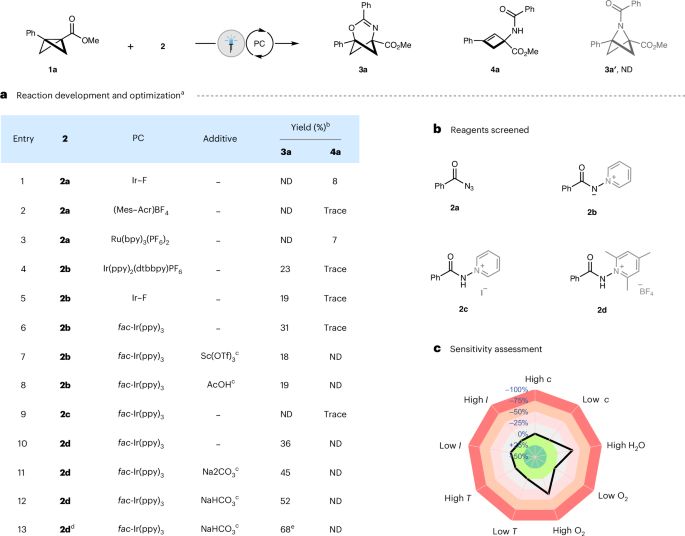
近期,相关研究展示了通过光氧化还原催化的高选择性和化学选择性将酰胺自由基插入双环[1.1.0]丁烷,从而直接获得2-氧-4-氮杂双环[3.1.1]庚-3-烯。这些C(sp³)富含异双环的结构与吡啶和嘧啶衍生物在几何上具有相似性,暗示它们作为重要药物异构体的潜力。以上成果在Nature Catalysis期刊上发表了题为“Photoredox-catalysed amidyl radical insertion to bicyclo[1.1.0]butanes”的最新论文。
因此,研究人员通过实现异双环[n.1.1]烷的合成,不仅为药物化学提供了新的思路,也为合成化学中的多样化构建模块奠定了基础。这一研究进展预示着在药物开发领域,异双环[n.1.1]烷将具有广泛的应用前景。

研究亮点
(1)本研究首次实现了对 bicyclo[1.1.0]butanes(BCBs)的 amidyl 自由基的高选择性插入,成功合成了 2-oxa-4-azabicyclo[3.1.1]hept-3-enes。通过使用 N-amidocollidinium 四氟硼酸盐作为 amidyl 自由基前体和 fac-Ir(ppy)3 作为光催化剂,研究人员克服了反应中多个潜在挑战,提供了高效合成途径。 (2)研究表明,这些新合成的异环双环化合物展示出良好的结构刚性和明确的出口向量,这些特性在药物化学中具有重要意义。此外,通过后续转化反应,进一步验证了这些异环双环化合物作为合成化学中多功能构建块的实用性。这些发现不仅丰富了异环双环[n.1.1]烷的合成方法学,还为药物开发中药效改造提供了新的潜在结构基础,尤其是作为吡啶和呋喃等重要药物异构体的替代物,显示出良好的药物化学应用前景。



结论展望
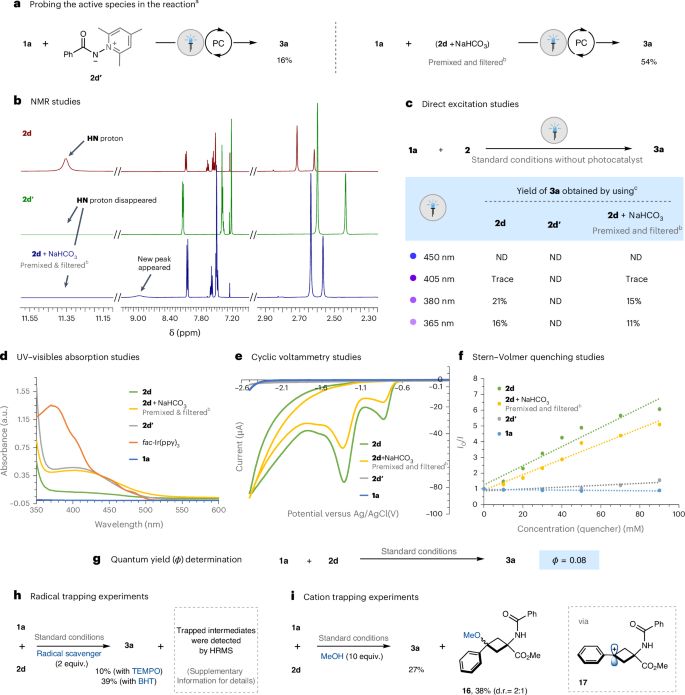
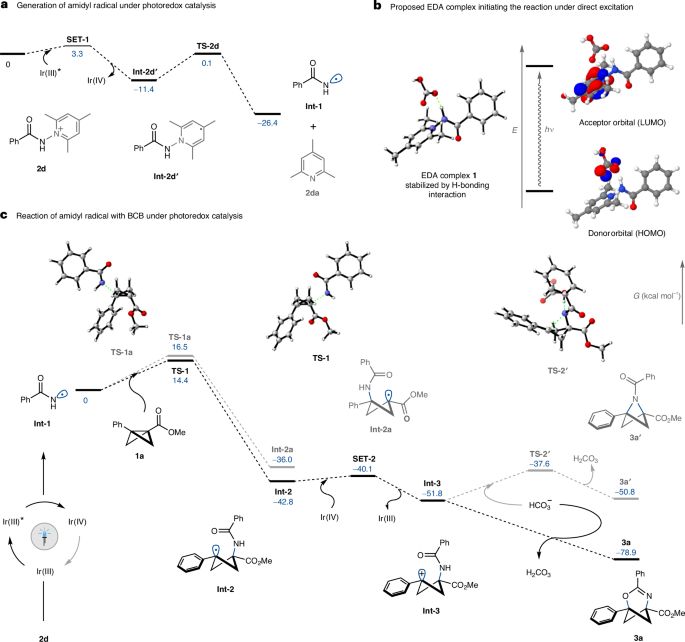
本文展示了一种新颖的光氧化还原催化方法,通过将酰胺基自由基选择性插入双环[1.1.0]丁烷(BCBs),成功合成了2-氧-4-氮杂双环[3.1.1]庚-3-烯。这一研究不仅克服了传统合成方法中的挑战,还提供了一种温和且高效的合成策略,展现了BCBs作为多功能构建块的巨大潜力。通过对反应机理的深入研究,本文揭示了反应的区域选择性和化学选择性,强调了计算化学在理解反应能量学中的重要性。 此外,2-氧-4-氮杂双环[3.1.1]庚-3-烯的后合成修饰进一步展示了其在合成化学中的广泛应用前景,尤其是作为药物分子的等体比拟物。总体而言,本文的工作为异双环[n.1.1]烷的合成提供了新思路,强调了异芳香基团的战略性插入在药物设计和开发中的重要性,开辟了进一步探索和开发新型药物候选物的可能性。
文献信息
Chintawar, C.C., Laskar, R., Rana, D. et al. Photoredox-catalysed amidyl radical insertion to bicyclo[1.1.0]butanes. Nat Catal (2024). https://doi.org/10.1038/s41929-024-01239-9
