AbMole精研抑制剂十年,最新的科研动态不断与您分享。本期与您分享的是:通过靶向人脐静脉内皮细胞和肾细胞癌中的细胞周期蛋白依赖性激酶7抑制血管生成:体外和体内研究。
癌细胞依赖异常转录来生长和存活。细胞周期蛋白依赖性激酶(CDK)通过调节RNA聚合酶II (RNAPII)的活性在调节基因转录中起关键作用。THZ1是CDK7的选择性共价抑制剂,在几种人类癌症中具有抗肿瘤作用。在这项研究中,研究了CDK7在调节内皮细胞和人肾细胞癌(RCC)的血管生成活性中的作用和治疗潜力。研究结果表明,血管内皮生长因子(VEGF)是血管生成的关键激活剂,可上调人脐静脉内皮细胞(HUVEC)中CDK7和RNAPII的表达,以及RNAPII在丝氨酸5和7处的磷酸化,表明转录活性CDK7的表达可能与VEGF激活的内皮血管生成活性有关。此外,通过抑制CDK7活性,THZ1抑制VEGF激活的增殖和迁移,以及增强HUVEC的凋亡。此外,THZ1抑制VEGF激活的毛细管形成,并且CDK7敲低持续减少HUVEC中的管形成。此外,THZ1降低了人类RCC细胞(786-O和Caki-2)中VEGF的表达,THZ1治疗抑制了RCC异种移植物中的肿瘤生长、血管分布和血管生成标志物(CD31)的表达。研究结果表明,CDK7介导的转录参与了内皮和人肾细胞癌的血管生成活性。THZ1抑制VEGF介导的VEGFR2下游血管生成激活,为RCC患者的抗肿瘤治疗提供了新的视角。

THZ1(Abmole,M5228,纯度98.33%)是一种是共价的CDK7抑制剂,在本研究中用于处理细胞,贯穿全程试验过程。

Figure 2. THZ1 suppressed the proliferation and chemotactic migration of HUVECs in a dosedepende
图2A说明VEGF刺激在24和48小时后显着增强了HUVEC增殖。刺激24和48小时后,THZ1剂量依赖性地抑制VEGF激活的内皮细胞增殖。此外,图2B,C说明VEGF显着促进了HUVEC的趋化性。THZ1以剂量依赖性方式显着抑制VEGF激活的内皮细胞迁移。结果表明CDK7抑制可干扰VEGF激活的内皮细胞增殖和迁移,表明CDK7相关转录与VEGF激活的血管生成密切相关。
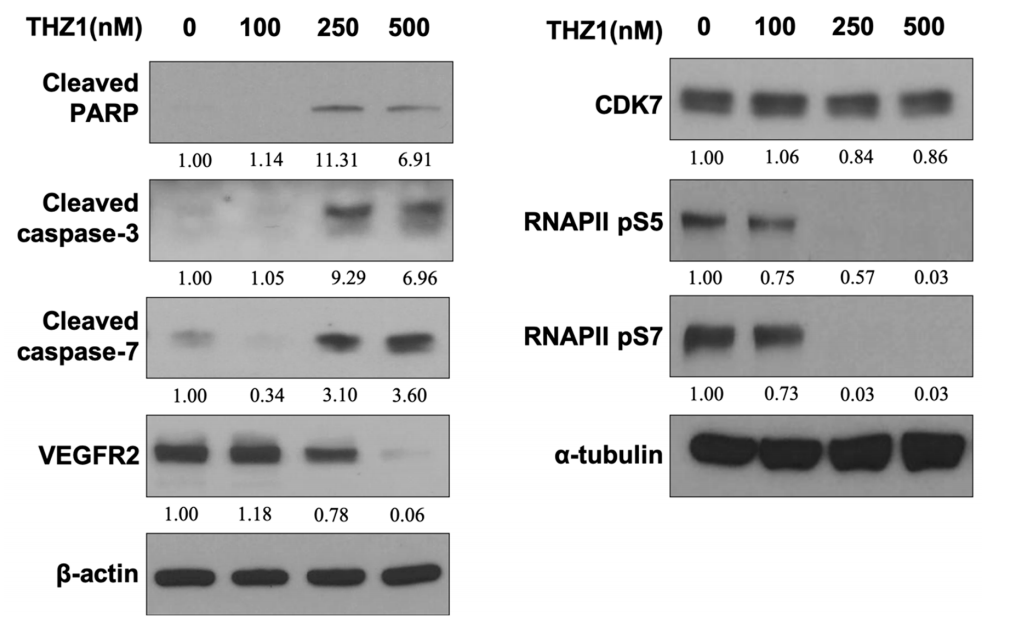
Figure 3. THZ1 induced apoptosis and suppressed VEGFR2 expression and RNA polymerase II
(RNAPII) C-terminal domain (CTD) phosphorylation at serine 5 and 7 in HUVECs.
图3显示THZ1没有显着影响CDK7的表达,但显着降低了HUVEC中丝氨酸5和7处的RNAPII CTD磷酸化。此外,THZ1剂量依赖性地降低VEGFR2表达并通过增强HUVEC中PARP和caspase-3和-7的切割诱导细胞凋亡。该数据(图3)表明THZ1抑制CDK7下游RNAPII信号传导,这导致CDK7相关转录活性对血管生成VEGFR2表达和HUVECs中并发凋亡的影响降低。我们得出结论,THZ1在不改变CDK7表达的情况下阻断了CDK7的活性位点,从而抑制下游RNAPII 5和7位丝氨酸的磷酸化,从而降低了内皮细胞的存活和血管生成。

Figure 4. THZ1-induced CDK7 inhibition or CDK7 knockdown suppressed angiogenesis in vitro and in vivo
THZ1介导的CDK7抑制降低了VEGFR2(一种最关键的血管生成受体)的表达,因此,进一步检查了THZ1在体外和体内系统中对血管生成的影响。如图4A所示,THZ1在体外抑制HUVEC中VEGF激活的血管生成管形成。此外,图4B说明THZ1在体内基质胶塞测定中抑制了VEGF刺激的血管生成。这些结果表明CDK7抑制阻断了内皮细胞血管。

Figure 5. THZ1 dose-dependently inhibited VEGF secretion and expression in Caki-2 and 786-O cells
基于本研究中CDK7与内皮细胞的血管生成活性的联系,评估了对RCC细胞的抗血管生成作用(图5)。结果表明,在治疗24和48小时后,THZ1剂量依赖性地抑制Caki-2(图5A)和786-O细胞(图5B)中VEGF的分泌和表达,表明THZ1在RCC抗血管生成治疗中的潜在应用。

Figure 6. THZ1 inhibited the tumor growth of human C-terminal domain (RCC) cells (Caki-2 and 786-O) with concurrent suppression of angiogenic activity in a xenograft mouse model.
小鼠腹腔注射盐水或THZ1 4周。随着时间的推移,肿瘤的出现和肿瘤体积如图6A所示。THZ1显着抑制RCC肿瘤的生长。此外,通过免疫组织化学染色(图6B)和蛋白质印迹分析(图6C)测定内皮标记物CD31的表达,进一步评估THZ1诱导的CDK7抑制对RCC血管生成的影响。免疫染色显示THZ1降低了肿瘤细胞簇之间的基质中的CD31表达(图6B),表明诱导血管生成。此外,Western印迹分析显示暴露于THZ1的Caki-2和786-O肿瘤中CD31表达水平降低(图6C)。这些数据表明THZ1可以减少血管生成,抑制RCC异种移植肿瘤的生长。然而,通过THZ1诱导的CDK7抑制在体内对人RCC的抗血管生成作用的潜在机制需要进一步探索。
鸣谢:Chung-Sheng Shi, et al. Cells. 2019 Nov 19;8(11):1469.
