Tregs通过多种机制发挥抑制作用,包括调节细胞因子微环境 、靶 T 细胞的代谢 、调节树突状细胞的活化 和直接抑制细胞溶解等 。
关键标记物TGF-β1-LAP-LRRC32转化生长因子-β(TGF-β),其最常见的亚型是 TGF-β1,是一种多效性细胞因子,于1986年首次被发现。TGF-β 后来成为免疫抑制和耐受研究领域的主要焦点,因为它对免疫反应有很强的抑制作用,尤其影响 T 细胞的增殖和分化 。2000年左右,多个研究小组确定 TGF-β 与 Tregs 的抑制功能之间的联系。(Cell contact-dependent immunosuppression by CD4(+)CD25(+) regulatory T cells is mediated by cell surface-bound transforming growth factor beta.)然而,TGF-β在Tregs免疫调节功能中的作用引发了争议,因为使用抗TGF-bβ抗体中和TGF-β,未能在体外逆转Tregs的抑制功能。2004 年,National Institute of Allergy and Infectious Diseases的研究者报道:潜伏期相关蛋肽 ( latency-associated peptide,LAP) 结合 Tregs 中TGF-β1 时,这个问题得到了解决。TGF-β1介导的免疫抑制分为两步:首先,TGF-β1与LAP解离,然后游离的TGF-b1可以与其受体相互作用。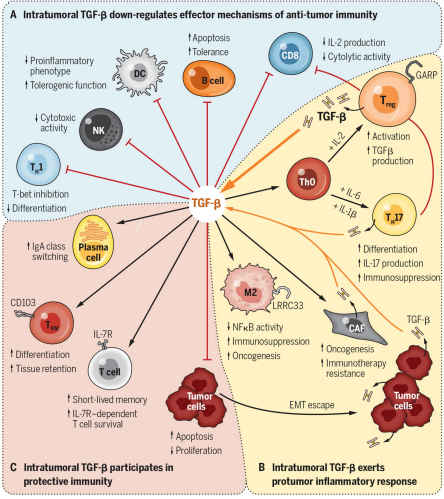

Journal of Investigative Dermatology (2006) 126, 15–24. doi:10.1038/sj.jid.5700004
新兴标志物近年来,一些新兴的标志物因其对Treg介导的免疫抑制的潜在贡献而受到关注。CD121CD121a 和 CD121b 是人Treg 上的两种独特的细胞表面抗原,它们在 TCR 介导的Treg 激活时瞬时表达,可将功能性 Treg 与激活的FOXP3- 和 FOXP3+ 非 Treg 区分开来。推荐将这两种高特异性表面标记物用于高产量、高纯度的Treg分离。CD69CD69 和 HLA-DR 被广泛认为是传统 T 细胞和 Treg 中活化诱导的细胞表面标志物,以及 Treg 分化和免疫抑制的标志物。CD69 与其配体 S100A8/S100A9 复合体结合后,可调节 Treg 分化。CD69 表达对 tTreg 发育至关重要 。此外,与 FOXP3+ CD69-Tregs 相比,FOXP3+ CD69+ Tregs 表达更高表面水平的抑制相关标志物,并显示出增强的抑制活性。CD69还通过促进 IL-10 的产生来增强 Tregs 的免疫抑制功能 。HLA-DR大约 1/3 的成人外周血 CD4 + 效应 Tregs 表达HLA-DR,从而识别出一个独特且功能强大的终末分化 Treg 亚群。HLA-DR+ Tregs 表现出更高水平的 FOXP3 ,并采用接触依赖性免疫抑制,表明出色的抑制能力 。CD101和CD129另外两种细胞表面受体CD101 和 CD129 与 Treg 抑制活性有关 。早期的小鼠研究表明,CD101 表面表达与体外和体内 CD4+ CD25+ Tregs 的抑制活性密切相关。然而,对人类Tregs的研究并未重复这一观察结果。同样,活化的 T 细胞产生的 IL-9 可促进 Th克隆的增殖,并增强表达 CD129(IL-9 受体)的 Tregs 的抑制功能。然而,由于缺乏更多的证据,这两种标记物目前研究渐少。CD103CD103,也称为整合素 αEβ7 (ITGAE),在大约 10-30% 的小鼠 pTreg 上表达。已发现 CD103+ Treg 表现出略高的抑制能力并表达更高水平的 IL-10,从而有助于其抗炎活性。但是,人 CD25+ FOXP3+ Tregs 在包括血液在内的各种组织中显示 CD103 的表达有限 (<5%)。趋化因子趋化因子控制着Tregs的运输和归巢,是其发挥抑制功能的重要基础。已确定几种整合素对Treg 功能和定位至关重要。αvβ8 整合素是激活潜伏性TGF-b 的关键,缺乏 avb8 的 Tregs 无法抑制体内 T 细胞介导的炎症 。a4β7整合素(也称为LPAM-1,其经典配体为MAD-CAM1)被认为在Tregs迁移到肠道和相关淋巴组织中起着至关重要的作用。β7的丢失已被证明导致迁移中断,随后出现结肠炎。CCR4在各种癌症模型中,CCR4的被证明可以介导Treg的迁移。肿瘤细胞相关巨噬细胞(TAMs)诱导了CCL22表达(CCR4的配体),促进其迁移至肿瘤微环境。CCR8C-C趋化因子受体8(CCR8)是一种趋化因子受体,其配体分别为CCL1、CCL8和CCL18,在肿瘤浸润treg的选择性表达。在一些小鼠模型中,CCR8+treg高表达与抑制功能相关,而抗CCR8抗体治疗可减少肿瘤体积,增强抗肿瘤免疫。共刺激/抑制受体CTLA -4细胞毒性 T 淋巴细胞相关抗原 4 (CTLA-4),在激活时在常规 T 细胞中表达,但它在静息 Tregs 中组成型表达,是该细胞亚群的标志之一。TCR 介导的激活后,人Tregs 强烈上调 CTLA-4。CTLA-4作为 FOXP3 的靶基因,是 Treg 增殖的内在调节因子。CTLA-4 的缺失或阻断会增强 Treg 增殖,并影响记忆 Treg 的数量和功能。PD-1PD-1是 Tregs 中发现的另一种 IgSF 的共抑制分子。2003 年,发现阻断 PD-1 与其配体 PD-L1 之间的相互作用会影响 Treg 抑制功能。2006年一项更全面的研究表明,新分离的小鼠和人 Treg 将PD-1 保留在细胞内区室中 ,在 TCR 刺激下迁移到细胞表面。Francisco 等人发现,PD-1 的表达通过促进 FOXP3 表达、增强 iTreg 抑制活性,将初始 CD4+ T 细胞最低限度地转化为诱导的 Tregs (iTregs) 。ICOS诱导型 T 细胞共刺激因子 (ICOS) 是免疫球蛋白分子超家族 (IgSF) 的另一个 CD28 相关成员,它通过作为共刺激受体发挥作用。ICOS+ T 细胞虽然在外周血 CD4+ T 细胞中占少数,但约占FOXP3+ Treg 的 20% ,并且 ICOS+ Tregs 能够产生 IL-10 并抑制 DC 上调的 CD86,而ICOS-Tregs 产生 TGFbβ。LAG-3Lag-3,也称为 CD223,最初被发现在活化的 CD4+ 和 CD8+ T 细胞上上调,随后发现在激活后在 tTregs 和 pTregs 中均高表达 。Tregs 上的 Lag-3 阻断消除了 Treg 抑制功能,而非 Treg CD4+ T 细胞中 Lag-3 的异位表达赋予了抑制活性。TIGITTIGIT 是脊髓灰质炎病毒受体 (PVR) 样 Ig SF 家族的成员,是一种在许多淋巴细胞亚群上表达的共抑制受体。它在Tregs上高度表达,促进抑制功能。2009 年报道了 TIGIT 与人类Treg 生物学之间的联系 (Yu X, Harden K C, Gonzalez L, Francesco M, Chiang E, Irving B, et al. The surface protein TIGIT suppresses T cell activation by promoting the generation of mature immunoregulatory dendritic cells. Nat Immunol (2009) 10(1):48–57. doi: 10.1038/ni.1674),然而,直到2014 年才显示其在 Tregs 中的功能作用 。Tregs 上 TIGIT 的激活会触发 IL-10 和 Fgl2 等抑制分子的产生。TIGIT 表达定义了一个 Treg 亚群,该亚群表现出对 Th1 和 Th17 的选择性抑制,但不抑制 Th2 反应, 在治疗疾病方面具有治疗潜力 。TIM-3Tim-3 (HAVCR2) 作为 T 细胞反应的潜在负调节分子而备受关注 ,在稳态条件下,Tim-3 的表达仅限于外围的一小部分 (2-5%) Treg。然而,在免疫应答期间,Tim-3 在 Tregs 上上调,在肿瘤的 Tregs 中表达升高。Tim-3+ Tregs 显示抑制分子(CTLA-4、Lag-3 和 PD-1)的表达增加,以及免疫抑制细胞因子(IL-10 和 TGF-b)的分泌增强。在临床级人类Tregs的体外扩增后,Tim-3水平大幅增加,增加到29%。分选的 Tim-3+ Treg 群体显示出 IL-10 和颗粒酶 B 产生的显着增强,表明该亚群的抑制能力及其作为基于细胞的疗法诱导同种异体移植物耐受性的潜力。GITR糖皮质激素诱导的肿瘤坏死因子受体相关蛋白 (GITR),也称为 TNFRSF18 和CD357,是一种共刺激分子。虽然在幼稚 T 细胞上表达水平较低,但 Tregs 和活化的 T 细胞显示出GITR 的高表面表达。
参考文献
Roberts AB, Sporn MB, Assoian RK, Smith JM, Roche NS, Wakefield LM, et al. Transforming growth factor type beta: rapid induction of fibrosis and angiogenesis in vivo and stimulation of collagen formation in vitro. Proc Natl Acad Sci U.S.A. (1986) 83 (12):4167–71. doi: 10.1073/pnas.83.12.4167 Nakamura K, Kitani A, Strober W. Cell contact-dependent immunosuppression by CD4(+)CD25(+) regulatory T cells is mediated by cell surface-bound transforming growth factor beta. J Exp Med (2001) 194(5):629–44. doi: 10.1084/jem.194.5.629Moreau JM, Velegraki M, Bolyard C, Rosenblum MD, Li Z. Transforming growth factor-b1 in regulatory T cell biology. Sci Immunol (2022) 7(69):eabi4613. doi: 10.1126/sciimmunol.abi4613Mandapathil M, Hilldorfer B, Szczepanski MJ, Czystowska M, Szajnik M, Ren J, et al. Generation and accumulation of immunosuppressive adenosine by human CD4 +CD25highFOXP3+ regulatory T cells. J Biol Chem (2010) 285(10):7176–86. doi: 10.1074/jbc.M109.047423Intratumoral regulatory T cells: markers, subsets and their impact on anti-tumor immunity, Immunology 2019, 157: 219-231